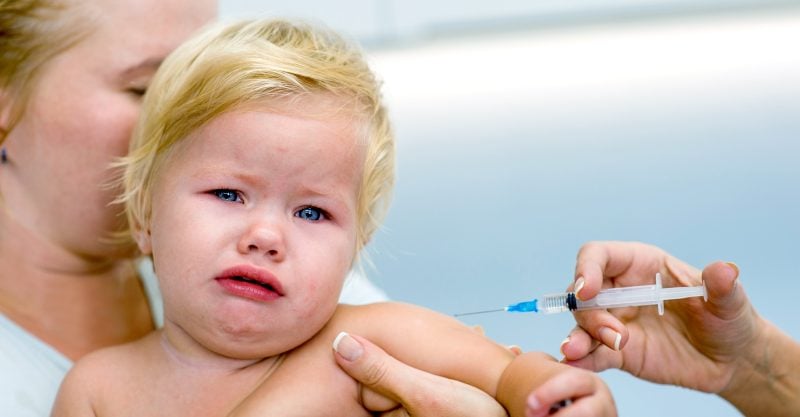
La Pfizer e la BioNTech pronte a testare una terza dose del loro vaccino anti-COVID su neonati e bambini dai 6 mesi ai 5 anni dopo che l’azienda ha comunicato che le due dosi iniziali non sono riuscite ad innescare una risposta immunitaria sufficiente nei bambini dai 2 ai 5 anni d’età.
Il 17 dicembre le aziende hanno detto che modificheranno i loro test clinici aggiungendo una terza dose di vaccino per quel gruppo di età dopo un periodo di almeno due mesi dalle due dosi iniziali.
Le aziende hanno testato una dose da 3 microgrammi del vaccino — un decimo della dose per adulti — nei bambini dai 6 mesi ai 5 anni di età. Dopo due dosi, i bambini tra i 6 mesi e i 2 anni hanno prodotto una risposta immunitaria paragonabile alle persone di età tra i 16 e i 25 anni, ma lo stesso non è stato riscontrato nei bambini tra i 2 e i 5 anni d’età.
“Lo studio includerà ora la valutazione di una terza dose di 3 [microgrammi] almeno due mesi dopo la seconda della serie di due dosi per fornire un alto livello di protezione in questo giovane gruppo di età”, le aziende hanno dichiarato in un comunicato stampa.
Il 17 dicembre, durante una conferenza telefonica con gli investitori e gli analisti, Kathrin Jansen, capo della ricerca sui vaccini di Pfizer, ha detto che se la nuova strategia funziona, “avremmo un approccio coerente di tre dosi di vaccino per tutte le età”.
Se le tre dosi innescano una sufficiente risposta immunitaria, le aziende si aspettano di presentare i dati alle autorità di controllo nella prima metà dell’anno, Il Washington Post ha riportato.
“È importante notare che questo aggiustamento non prevede che le nostre aspettative cambino significativamente dal poter presentare un’istanza di Autorizzazione per Uso di Emergenza e una approvazione condizionata nel secondo trimestre del 2022″, ha detto Jansen.
“Penso che una terza dose darà un buon incremento, e onestamente, questo è davvero entusiasmante — come sappiamo dai dati sugli adulti, tre dosi sono probabilmente meglio per Omicron“, ha detto al Washington Post il dottor Kawsar Talaat, un ricercatore principale della sperimentazione pediatrica Pfizer e medico alla Johns Hopkins Bloomberg School of Public Health. “E penso che sarà bene avere dati simili per i bambini”.
Secondo il comunicato stampa della Pfizer, lo studio di fase 1/2/3 ha inizialmente arruolato fino a 4.500 bambini di età compresa tra i 6 mesi e i 12 anni negli Stati Uniti, Finlandia, Polonia e Spagna provenienti da più di 90 siti di sperimentazione clinica.
La Pfizer ha detto che il suo studio è stato progettato per valutare la sicurezza, la tollerabilità e l’immunogenicità del vaccino Pfizer-BioNTech su un programma a due dosi in tre gruppi di età: età dai 5 a meno di 12 anni, età dai 2 a meno di 5 anni e età dai 6 mesi a meno di 2 anni.
Lo studio ha arruolato bambini con o senza precedenti infezioni provate da SARS-CoV-2, nonostante più di 140 studi dimostrino che l’immunità naturale derivata da una precedente infezione da SARS-CoV-2 è di lunga durata, robusta e durevole.
Le case farmaceutiche stanno anche testando una terza dose nei bambini dai 5 agli 11 anni e una terza dose per gli adolescenti tra i 12 e i 17 anni.
Pfizer-BioNTech hanno detto che la loro decisione è stata informata confrontando la risposta immunitaria nei bambini più piccoli con quella degli adolescenti e giovani adulti, e dai dati emergenti — generati dalla Pfizer — che tre dosi risultano più protettive contro le varianti come Omicron. Gli ultimi dati provenienti dalla People’s Vaccine Alliance rivelano che Pfizer, BioNTech e Moderna stanno facendo profitti combinati di 65.000 dollari ogni minuto, o 93,5 milioni di dollari al giorno.
Nella sua dichiarazione finanziaria del terzo trimestre, la Pfizer prevede 36 miliardi di dollari in ricavati dai vaccini per il 2021, anche se il profitto lordo dalle entrate è diviso 50/50 con BioNTech.
Durante una chiamata in febbraio riguardante i profitti, Albert Bourla, CEO della Pfizer, ha assicurato gli investitori che, con il calo della domanda iniziale del vaccino anti COVID, l’azienda avrebbe potuto assicurarsi profitti significativi facendo pagare prezzi più alti e implementando dosi di richiamo di routine per nuove varianti del virus.
Durante la Barclays Global Health Conference a marzo, il CFO (direttore finanziario) Frank D’Amelio ha detto che l’azienda non vede la vaccinazione come un evento unico, ma “come qualcosa che continuerà per il prossimo futuro”.