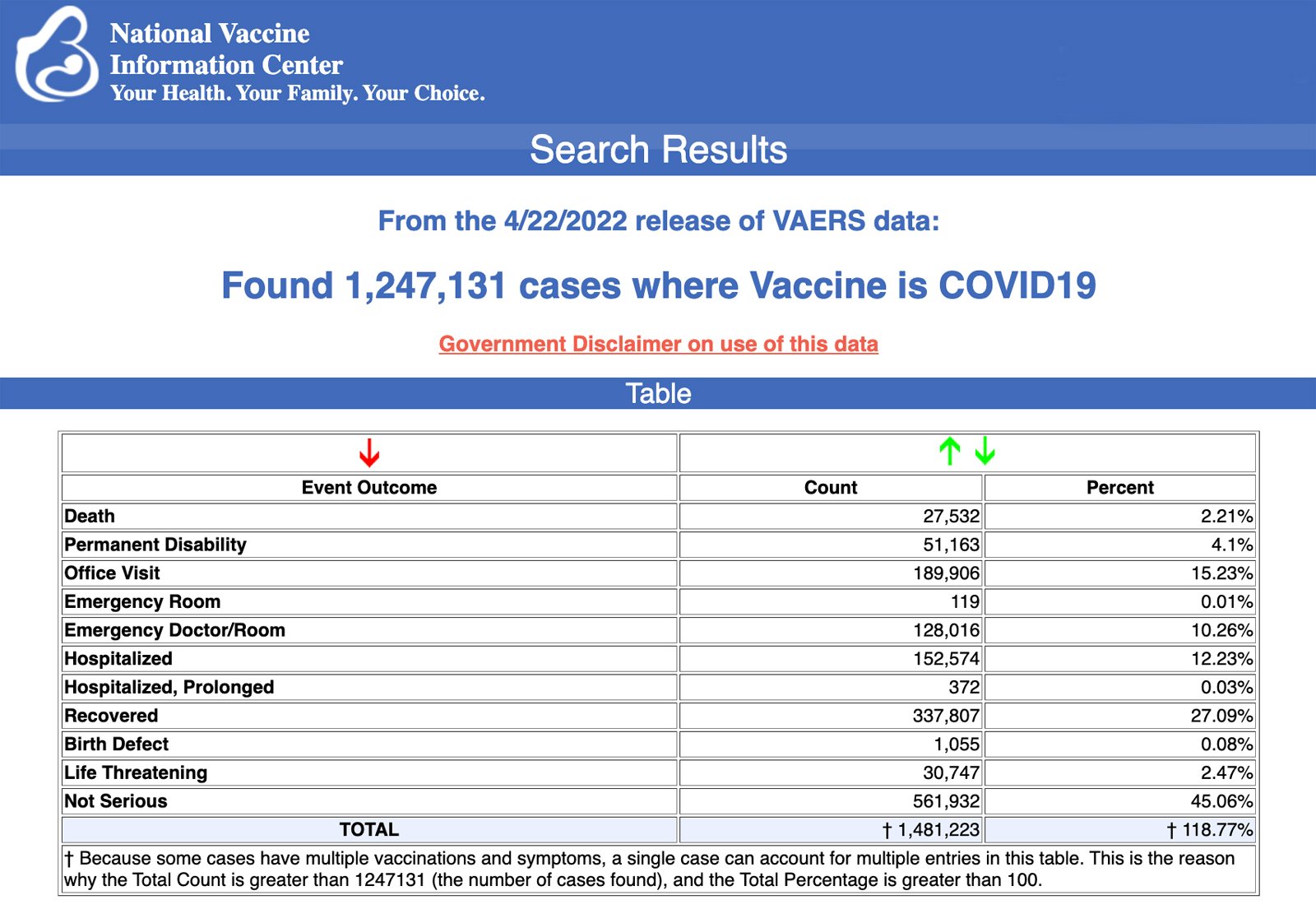
I Centers for Disease Control and Prevention (CDC) hanno rilasciato oggi nuovi dati che mostrano che tra il 14 dicembre 2020 e il 22 aprile 2022 un totale di 1.247.131 segnalazioni di eventi avversi sono state presentate al Vaccine Adverse Event Reporting System (VAERS) in seguito a vaccinazioni anti COVID-19. VAERS è il principale sistema, finanziato dal governo, per la segnalazione di reazioni avverse ai vaccini negli Stati Uniti.
I dati includevano un totale di 27.532 segnalazioni di decessi – un aumento di 183 rispetto alla settimana precedente – e 224.766 lesioni gravi, compresi i decessi, durante lo stesso periodo di tempo – un aumento di 1.930 rispetto alla settimana precedente.
Escludendo le “segnalazioni straniere” al VAERS, negli Stati Uniti tra il 14 dicembre 2020 e il 22 aprile 2022 sono stati segnalati 810.171 eventi avversi, compresi 12.672 decessi e 80.743 lesioni gravi.
Le segnalazioni provenienti da fonti estere sono segnalazioni che le filiali estere inviano ai produttori di vaccini statunitensi. Secondo le normative della Food and Drug Administration (FDA, Agenzia federale per il controllo degli Alimenti e dei Medicinali degli Stati Uniti) se un produttore viene informato di una segnalazione proveniente da una fonte estera che descrive una reazione avversa che non solo è grave ma non appare sull’etichettatura del prodotto, il produttore è tenuto a inviare la segnalazione al VAERS.
Dei 12.672 decessi segnalati negli Stati Uniti al 22 aprile, il 16% si è verificato entro 24 ore dalla vaccinazione, il 20% entro 48 ore dalla vaccinazione e il 59% si è verificato in persone che hanno avuto un inizio di sintomi entro 48 ore dalla vaccinazione.
Negli Stati Uniti, al 23 aprile erano state somministrate 572 milioni di dosi di vaccino anti COVID-19, di cui 338 milioni di dosi Pfizer, 215 milioni di dosi Moderna e 19 milioni di dosi Johnson & Johnson (J&J).
Tutti i venerdì, il VAERS pubblica le segnalazioni delle reazioni avverse ai vaccini a partire da una data specifica. Le segnalazioni inviate al VAERS richiedono ulteriori indagini prima che si possa confermare una relazione causale.
Storicamente, è stato dimostrato che il VAERS riporta solo l’1% delle effettive reazioni avverse ai vaccini.
I dati VAERS degli Stati Uniti dal 14 dicembre 2020 al 22 aprile 2022 per i bambini dai 5 agli 11 anni mostrano:
- 10.348 eventi avversi, compresi 256 classificati come gravi e 5 decessi riportati.
- 19 segnalazioni di miocardite e pericardite (infiammazione del cuore).
Il CDC usa una definizione di caso ristretta per la “miocardite”, che esclude i casi di arresto cardiaco, le ischemie e i decessi dovuti a problemi cardiaci che si verificano prima che si abbia la possibilità di raggiungere il Pronto Soccorso. The Defender ha notato, nelle settimane precedenti, che il CDC ha rimosso diversi rapporti di miocardite e pericardite dal sistema VAERS per questo gruppo di età. Non è stata fornita alcuna spiegazione. - 42 segnalazioni di disturbi della coagulazione del sangue.
I dati VAERS riguardanti gli Stati Uniti dal 14 dicembre 2020 al 22 aprile 2022 per i bambini dai 12 ai 17 anni mostrano:
- 31.455 eventi avversi, tra cui 1.803 classificati come gravi e 44 decessi segnalati. La morte più recente segnalata riguarda una ragazza di 14 anni del Tennessee (VAERS I.D. 2238618) che è morta dopo aver ricevuto la seconda dose di vaccino anti COVID-19 della Pfizer. Secondo il rapporto VAERS, la ragazza aveva una storia precedente di cancro ma è stata ricoverata 29 giorni dopo aver ricevuto la seconda dose di Pfizer con COVID-19 grave e polmonite da COVID. Da “malata critica”, ha poi sviluppato un’insufficienza respiratoria e bradicardia ed è morta.
- 65 segnalazioni di anafilassi tra ragazzi dai 12 ai 17 anni d’età in cui la reazione è stata pericolosa per la vita, ha richiesto un trattamento ospedaliero o ha causato il decesso — con il 96% dei casi attribuiti al vaccino della Pfizer.
- 649 segnalazioni di miocardite e pericardite – due in meno della settimana scorsa – con 637 casi attribuiti al vaccino della Pfizer.
- 165 segnalazioni di disturbi della coagulazione del sangue – 1 in meno della settimana scorsa – con tutti i casi attribuiti a Pfizer.
I dati VAERS degli Stati Uniti dal 14 dicembre 2020 al 22 aprile 2022, per tutti i gruppi di età combinati, mostrano:
- Il 20% dei decessi era correlato a disturbi cardiaci.
- Il 54% delle persone decedute era di sesso maschile, il 41% era di sesso femminile e le restanti segnalazioni di decesso non includevano il sesso dei deceduti.
- L’età media alla morte era di 73 anni.
- Al 22 aprile, 5.460 donne incinte hanno segnalato eventi avversi legati ai vaccini anti COVID-19, compresi 1.709 segnalazioni di aborto spontaneo o parto prematuro.
- Dei 3.630 casi di paralisi di Bell riportati – tre in meno della settimana scorsa – il 51% è stato attribuito alle vaccinazioni Pfizer, il 40% a Moderna e l’8% a J&J.
- 870 segnalazioni di sindrome di Guillain-Barré, con il 42% dei casi attribuiti a Pfizer, 30% a Moderna e 28% a J&J.
- 2.343 segnalazioni di anafilassi – 12 segnalazioni in meno rispetto alla settimana scorsa – in cui la reazione è stata pericolosa per la vita, ha richiesto un trattamento o ha portato alla morte.
- 1.678 segnalazioni di infarto miocardico.
- 13.826 segnalazioni di disturbi della coagulazione del sangue negli Stati Uniti. Di queste, 6.199 segnalazioni sono state attribuite a Pfizer, 4.925 segnalazioni a Moderna e 2.661 segnalazioni a J&J.
- 4.152 casi di miocardite e pericardite con 2.544 casi attribuiti a Pfizer, 1.415 casi a Moderna e 181 casi al vaccino COVID-19 di J&J.
La FDA si riunirà a giugno riguardo i vaccini anti COVID-19 per neonati e bambini piccoli
La FDA si riunirà a giugno – l’8, il 21 o il 22 giugno – per discutere dei vaccini anti COVID-19 per i bambini sotto i 6 anni. Il comitato consultivo sui vaccini dell’agenzia, durante la sua riunione di giugno, discuterà anche la richiesta di Novavax per l’autorizzazione all’uso di emergenza (EUA) del suo vaccino anti COVID-19 per gli adulti.
Giovedì Moderna ha chiesto alla FDA di autorizzare il suo vaccino anit COVID-19 per l’uso di emergenza per i bambini dai 6 mesi ai 6 anni.
L’azienda ha condotto prove separate per due versioni del vaccino, una per neonati e bambini da 6 mesi a 2 anni, e una per bambini da 2 a 6 anni.
L’azienda ha affermato che i dati hanno mostrato “una robusta risposta anticorpale neutralizzante” e “un profilo di sicurezza favorevole”. Ma gli esperti dicono che Moderna non sta fornendo i dati necessari per calcolare il rischio-beneficio del suo vaccino anti COVID.
Lo studio KidCOVE di Moderna citato nel comunicato stampa di giovedì mostra che l’iniezione Moderna non è riuscita a soddisfare i requisiti minimi di efficacia della FDA per l’EUA nel gruppo di età dai 2 ai 6 anni, e ha superato appena il requisito di efficacia del 50% nel gruppo di età da 6 mesi a 2 anni dopo che il produttore del vaccino ha cambiato la sua analisi dello studio per soddisfare la soglia.
Nel gruppo di età inferiore, Moderna ha detto che l’efficacia del suo vaccino era del 51%. Nel gruppo di età maggiore, l’efficacia del vaccino era solo del 37% – sostanzialmente inferiore al requisito della FDA. Questi sono numeri di efficacia diversi da quelli che l’azienda ha riportato il mese scorso.
Pfizer dovrebbe presentare la sua domanda a maggio per una vaccinazione a tre dosi con dosi individuali più piccole per i bambini sotto i 5 anni.
I legislatori spingono la FDA sulle iniezioni anti COVID-19 per i più giovani
L’annuncio di Moderna segue di pochi giorni la richiesta alla FDA da parte dell’House Select Subcommittee on Coronavirus Crisis (Sottocomitato ristretto della Camera sulla crisi del coronavirus) di un aggiornamento sullo stato dei vaccini anti COVID-19 per i bambini sotto i 5 anni per la preoccupazione che “milioni di bambini ancora non siano protetti perché nessun vaccino è stato ancora autorizzato” per questo gruppo di età.
Un alto funzionario della FDA martedì ha detto al New York Times che l’agenzia non ha autorizzato un vaccino anti COVID-19 per la fascia di età più giovane perché Pfizer e Moderna non hanno finito le loro domande di autorizzazione.
L’agenzia ha detto la scorsa settimana che sta considerando di rinviare l’esame della richiesta di autorizzazione di Moderna per il suo vaccino anti COVID-19 per i bambini sotto i 5 anni fino a quando non avrà dati da Pfizer e BioNTech sul loro vaccino per bambini, spingendo la prima autorizzazione possibile di un vaccino da maggio a giugno.
La FDA ha detto che sarebbe stato più semplice e avrebbe creato meno confusione autorizzare e promuovere simultaneamente due vaccini al pubblico, piuttosto che dare il via libera a uno, velocizzandone i tempi rispetto all’altro.
I funzionari dell’agenzia erano preoccupati di autorizzare il vaccino Moderna solo per scoprire dopo poche settimane che quello della Pfizer offriva una protezione migliore.
Pfizer richiede l’EUA per la dose di richiamo per i bambini dai 5 agli 11 anni
Pfizer e BioNTech martedì hanno annunciato di aver richiesto l’EUA per una dose di richiamo anti COVID-19 per bambini dai 5 agli 11 anni. In un comunicato stampa, Pfizer ha citato i dati della sua sperimentazione di fase 2/3, secondo i quali una terza dose ha prodotto una “forte risposta immunitaria” nel gruppo di età più giovane quando somministrata sei mesi dopo la seconda dose.
I dati si basavano su un piccolo studio riguardante solo 140 bambini dai 5 agli 11 anni che hanno ricevuto una dose di richiamo sei mesi dopo la seconda dose del vaccino anti COVID di Pfizer-BioNTech come parte della serie primaria.
Pfizer ha detto che 30 bambini che hanno partecipato allo studio hanno rivelato un aumento di 36 volte degli anticorpi contro il virus – livelli abbastanza alti per combattere la variante Omicron, che attualmente non è la variante dominante negli Stati Uniti.
Gli esperti hanno detto a The Defender che “lo studio clinico utilizzato per sostenere l’idea di un richiamo anti COVID-19 per i bambini dai 5 agli 11 anni è del tutto inadeguato per fare una raccomandazione del genere”.
La Danimarca sospende la campagna di vaccinazione anti COVID-19
La Danimarca martedì è diventata il primo paese a sospendere la sua campagna nazionale di vaccinazione anti COVID-19 dopo che i funzionari sanitari hanno detto che la pandemia è sotto controllo.
Bolette Soborg, direttore del dipartimento delle malattie infettive dell’autorità sanitaria danese, ha detto che la Danimarca sta “chiudendo” il programma di vaccinazione di massa, e dopo il 15 maggio non saranno più emessi inviti per le vaccinazioni.
Le autorità sanitarie pubbliche hanno citato diversi fattori che hanno contribuito alla decisione di porre fine alla campagna di vaccinazione nazionale. Questi includono un calo nel numero di nuove infezioni segnalate, tassi di ospedalizzazione stabilizzati e un alto livello generale di vaccinazione.
La Danimarca prevede di riaprire il programma di vaccinazione in autunno, che sarà preceduto da una valutazione professionale approfondita di chi e quando vaccinare, e con quali vaccini.
La decisione arriva pochi mesi dopo che la Danimarca ha eliminato tutte le restrizioni legate alla COVID-19, diventando il primo stato membro dell’Unione Europea a farlo.
Children’s Health Defense incoraggia chiunque abbia avuto una reazione avversa, a qualsiasi vaccino, di fare una segnalazione seguendo questi tre punti.