Los Centros para el Control y la Prevención de Enfermedades (“Centers for Disease Control and Prevention”, CDC por sus siglas en inglés) han publicado hoy nuevos datos que muestran que entre el 14 de diciembre de 2020 y el 22 de abril de 2022 se enviaron al Sistema de Notificación de Eventos Adversos a las Vacunas (“Vaccine Adverse Event Reporting System”, VAERS por sus siglas en inglés) un total de 1.247.131 informes de eventos adversos tras las vacunas COVID-19. El VAERS es el principal sistema financiado por el gobierno para notificar las reacciones adversas a las vacunas en los Estados Unidos.
Los datos incluían un total de 27.532 notificaciones de muertes -un aumento de 183 respecto a la semana anterior- y 224.766 heridos graves, incluidas las muertes, durante el mismo periodo de tiempo -un aumento de 1.930 respecto a la semana anterior-.
Excluyendo las “notificaciones extranjeras” al VAERS, entre el 14 de diciembre de 2020 y el 22 de abril de 2022 se notificaron en Estados Unidos 810.171 eventos adversos, incluyendo 12.672 muertes y 80.743 lesiones graves.
Los informes extranjeros son informes que las filiales extranjeras envían a los fabricantes de vacunas de Estados Unidos. De acuerdo con la normativa de la Administración de Alimentos y Medicamentos de Estados Unidos (“Food and Drug Administration”, FDA por sus siglas en inglés), si se notifica a un fabricante un informe de un caso extranjero que describa un suceso que sea grave y que no aparezca en el etiquetado del producto, el fabricante está obligado a presentar el informe a VAERS.
De las 12.672 muertes notificadas en Estados Unidos hasta el 22 de abril, el 16% se produjeron en las 24 horas siguientes a la vacunación, el 20% en las 48 horas siguientes a la vacunación y el 59% en personas que experimentaron un inicio de síntomas dentro de las 48 horas siguientes a la vacunación.
En Estados Unidos se habían administrado 572 millones de dosis de la vacuna COVID-19 hasta el 23 de abril, de las cuales 338 millones corresponden a Pfizer, 215 millones a Moderna y 19 millones a Johnson & Johnson (J&J).
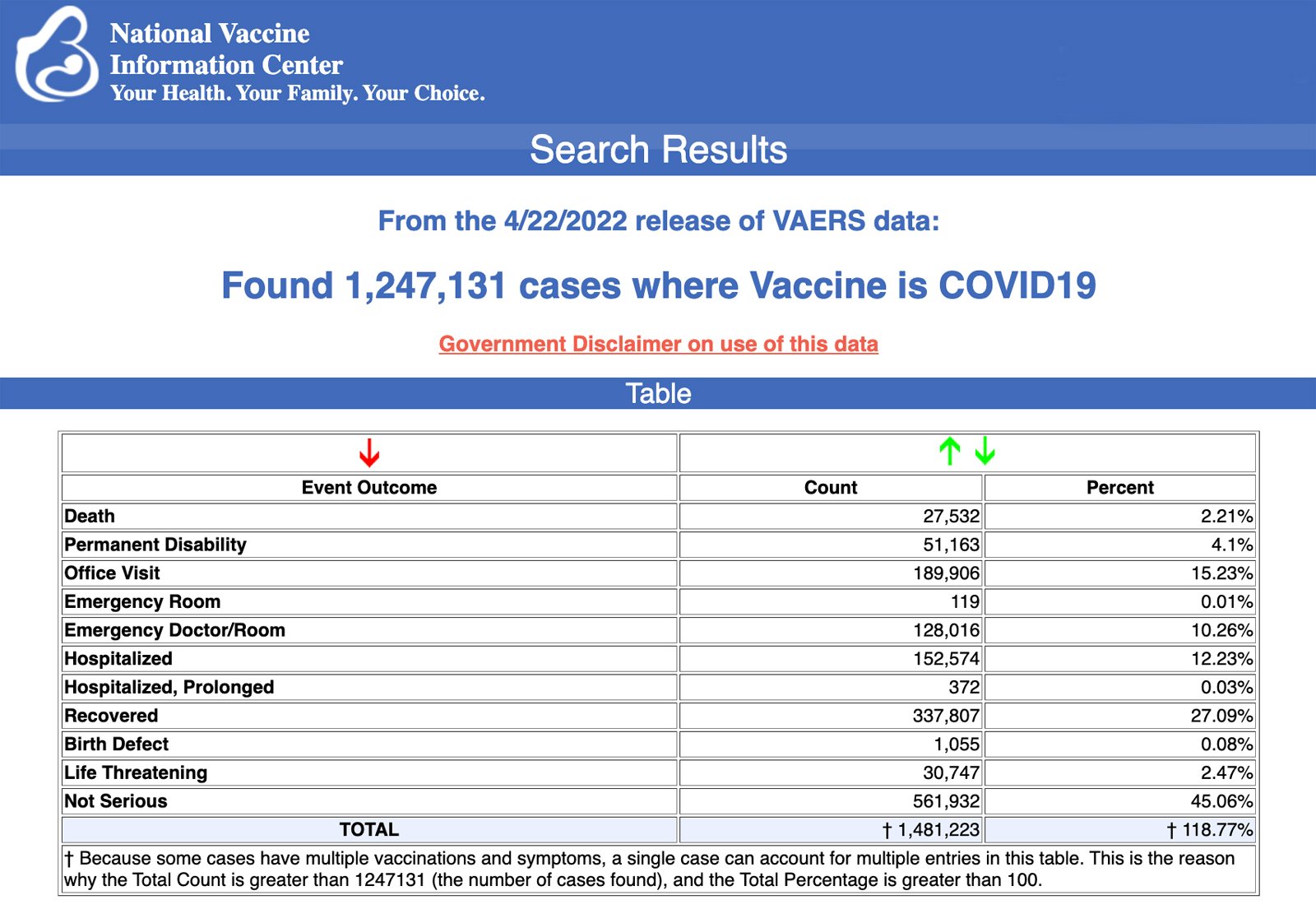
Todos los viernes, el VAERS publica los informes de lesiones por vacunas recibidos hasta una fecha determinada. Los informes enviados a VAERS requieren una investigación más profunda antes de poder confirmar una relación causal.
Históricamente, se ha demostrado que VAERS sólo recibe informes del 1% de los efectos adversos reales de las vacunas.
Los datos del VAERS de Estados Unidos del 14 de diciembre de 2020 al 22 de abril de 2022, para niños de 5 a 11 años, muestran:
- 10.348 eventos adversos, incluyendo 256 calificados como graves y 5 muertes notificadas.
- 19 informes de miocarditis y pericarditis (inflamación del corazón).
Los CDC utilizan una definición de caso restringida de “miocarditis”, que excluye los casos de parada cardíaca, accidentes cerebrovasculares isquémicos y muertes por problemas cardíacos que se producen antes de tener la oportunidad de acudir al servicio de urgencias. “The Defender” ha observado durante las últimas semanas que los CDC han eliminado del sistema VAERS varios informes de miocarditis y pericarditis en este grupo de edad. No se ha dado ninguna explicación. - 42 informes sobre trastornos de coagulación de la sangre.
Los datos del VAERS de EE.UU. del 14 de diciembre de 2020 al 22 de abril de 2022 para niños de 12 a 17 años muestran:
- 31.455 efectos adversos, de los cuales 1.803 fueron calificados como graves y 44 fueron mortales. La muerte más reciente es la de una niña de 14 años de Tennessee (VAERS I.D. 2238618) que murió tras recibir su segunda dosis de la vacuna COVID-19 de Pfizer. Según el informe del VAERS, la niña tenía antecedentes de cáncer, pero fue hospitalizada 29 días después de recibir su segunda dosis de Pfizer con neumonía grave por COVID-19 y COVID. Se puso “en estado crítico”, desarrolló una insuficiencia respiratoria y bradicardia y posteriormente falleció.
- 65 informes de anafilaxia entre jóvenes de 12 a 17 años en los que la reacción puso en peligro la vida, requirió tratamiento o provocó la muerte, y el 96% de los casos se atribuyeron a la vacuna de Pfizer.
- 649 informes de miocarditis y pericarditis – dos menos que la semana pasada – con 637 casos atribuidos a la vacuna de Pfizer.
- 165 informes de trastornos de coagulación de la sangre – 1 menos que la semana pasada – con todos los casos atribuidos a Pfizer.
Los datos del VAERS de Estados Unidos del 14 de diciembre de 2020 al 22 de abril de 2022, para todos los grupos de edad combinados, muestran:
- El 20% de las muertes estaban relacionadas con trastornos cardíacos.
- El 54% de los fallecidos eran hombres, el 41% eran mujeres y el resto de los informes de defunción no incluían el sexo del fallecido.
- La edad media de fallecimiento era de 73 años.
- Hasta el 22 de abril, 5.460 mujeres embarazadas informaron de acontecimientos adversos relacionados con las vacunas COVID-19, incluidos 1.709 informes de abortos o partos prematuros.
- De los 3.630 casos de parálisis de Bell notificados -tres menos que la semana pasada-, el 51% se atribuyó a las vacunas de Pfizer, el 40% a las de Moderna y el 8% a las de J&J.
- 870 informes sobre el síndrome de Guillain-Barré, con el 42% de los casos atribuidos a Pfizer, el 30% a Moderna y el 28% a J&J.
- 2.343 notificaciones de anafilaxia -12 menos que la semana pasada- en las que la reacción puso en peligro la vida, requirió tratamiento o provocó la muerte.
- 1.678 informes de infarto de miocardio.
- 13.826 informes de trastornos de coagulación de la sangre en los Estados Unidos. De ellos, 6.199 informes se atribuyeron a Pfizer, 4.925 informes a Moderna y 2.661 informes a J&J.
- 4.152 casos de miocarditis y pericarditis con 2.544 casos atribuidos a la vacuna de Pfizer, 1.415 casos a la de Moderna y 181 casos a la vacuna COVID-19 de J&J.
La FDA se reunirá en junio sobre las vacunas COVID-19 para bebés y niños pequeños
La FDA se reunirá en junio -el 8, 21 o 22 de junio- para debatir las vacunas COVID-19 para niños menores de 6 años. El comité consultivo de vacunas de la agencia, durante su reunión de junio, también debatirá la solicitud de Novavax de autorización de uso de emergencia (“Emergency Use Authorization”, EUA por sus siglas en inglés) de su vacuna COVID-19 para adultos.
Moderna solicitó el jueves a la FDA que autorizara su vacuna COVID-19 para uso de emergencia en niños de 6 meses a 6 años.
La empresa realizó ensayos separados para dos versiones de la vacuna, una para bebés y niños pequeños de 6 meses a 2 años, y otra para niños de 2 a 6 años.
La empresa afirmó que los datos mostraban “una sólida respuesta de anticuerpos neutralizantes” y “un perfil de seguridad favorable”. Sin embargo, los expertos afirman que Moderna no proporciona los datos necesarios para calcular la relación riesgo-beneficio de su vacuna COVID.
El estudio de KidCOVE de Moderna citado en el comunicado de prensa del jueves muestra que la inyección de Moderna no cumplió los requisitos mínimos de eficacia de la FDA para la EUA en el grupo de edad de 2 a 6 años, y apenas superó los requisitos de eficacia del 50% requeridos por la agencia en el grupo de edad de 6 meses a 2 años después de que el fabricante de la vacuna cambiara su análisis del estudio para alcanzar el umbral.
En el grupo de edad más joven, Moderna dijo que la eficacia de su vacuna era del 51%. En el grupo de mayor edad, la eficacia de la vacuna fue sólo del 37%, sustancialmente inferior a la exigida por la FDA. Estas cifras de eficacia son diferentes a las que la empresa comunicó el mes pasado.
Se espera que Pfizer presente su solicitud en mayo para una vacunación de tres inyecciones con dosis individuales más pequeñas para niños menores de 5 años.
Los legisladores presionan a la FDA sobre las vacunas COVID-19 para los más jóvenes
El anuncio de Moderna se produjo pocos días después de que el Subcomité Selecto de la Cámara de Representantes sobre la Crisis de los Coronavirus solicitara a la FDA una actualización del estado de las vacunas contra el COVID-19 para niños menores de 5 años por la preocupación de que “millones de niños pequeños sigan sin estar protegidos porque todavía no se ha autorizado ninguna vacuna” para este grupo de edad.
Un alto funcionario de la FDA el martes dijo a “The New York Times” que la agencia no ha autorizado la vacuna COVID-19 para el grupo de edad más joven porque Pfizer y Moderna no han terminado sus solicitudes de autorización.
La agencia dijo la semana pasada que está considerando retrasar la revisión de la solicitud de Moderna para autorizar su vacuna COVID-19 para niños menores de 5 años hasta que tenga los datos de Pfizer y BioNTech sobre su vacuna para niños, retrasando la autorización más temprana posible de una vacuna de mayo a junio.
La FDA dijo que sería más sencillo y menos confuso simultáneamente autorizar y promocionar dos vacunas al público, en lugar de dar luz verde a una en un calendario más rápido y a la otra más adelante.
Los funcionarios de la agencia estaban preocupados por autorizar la vacuna de Moderna sólo para descubrir unas semanas después que la de Pfizer ofrecía una mejor protección.
Pfizer solicita la aprobación de la EUA para una dosis de refuerzo para niños de 5 a 11 años
Pfizer y BioNTech anunciaron el martes que habían solicitado la autorización de comercialización de una dosis de refuerzo de COVID-19 para niños de 5 a 11 años. En un comunicado de prensa, Pfizer citó datos de su ensayo de fase 2/3 que afirmaban que una tercera dosis producía una “fuerte respuesta inmunitaria” en el grupo de edad más joven cuando se administraba seis meses después de la segunda dosis.
Los datos se basan en un pequeño estudio en el que sólo participaron 140 niños de 5 a 11 años que recibieron una dosis de refuerzo seis meses después de la segunda dosis de la vacuna COVID de Pfizer-BioNTech como parte de la serie primaria.
Pfizer dijo que 30 niños que participaron en el estudio revelaron un aumento de 36 veces en los anticuerpos que combaten el virus, niveles lo suficientemente altos como para combatir la variante Omicron, que actualmente no es la variante dominante en los Estados Unidos.
Los expertos dijeron a “The Defender” que el “ensayo clínico utilizado para apoyar la noción de un refuerzo de COVID-19 para niños de 5 a 11 años es totalmente inadecuado para hacer cualquier recomendación de este tipo.”
Dinamarca suspende la campaña de vacunación contra la COVID-19
Dinamarca se convirtió el martes en el primer país en suspender su campaña nacional de vacunación contra la COVID-19 después de que las autoridades sanitarias dijeran que la pandemia está controlada en ese país.
Bolette Soborg, directora del departamento de enfermedades infecciosas de la Autoridad Sanitaria danesa, dijo que Dinamarca está “reduciendo” el programa de vacunación masiva, y que las invitaciones para la vacunación ya no se emitirán después del 15 de mayo.
Las autoridades de salud pública citaron varios factores que contribuyeron a la decisión de poner fin a la campaña nacional de vacunación. Entre ellas se encuentran el descenso del número de nuevas infecciones notificadas, la estabilización de las tasas de hospitalización y un nivel general de vacunación elevado.
Dinamarca tiene previsto reabrir el programa de vacunación en otoño, lo que irá precedido de una evaluación profesional exhaustiva sobre quién y cuándo vacunar, y con qué vacunas.
La decisión llega apenas unos meses después de que Dinamarca eliminara todas las restricciones relacionadas con la COVID-19, convirtiéndose en el primer Estado miembro de la Unión Europea en hacerlo.
“Children’s Health Defense” pide a cualquier persona que haya experimentado una reacción adversa a cualquier vacuna, que presente un informe siguiendo estos tres pasos.