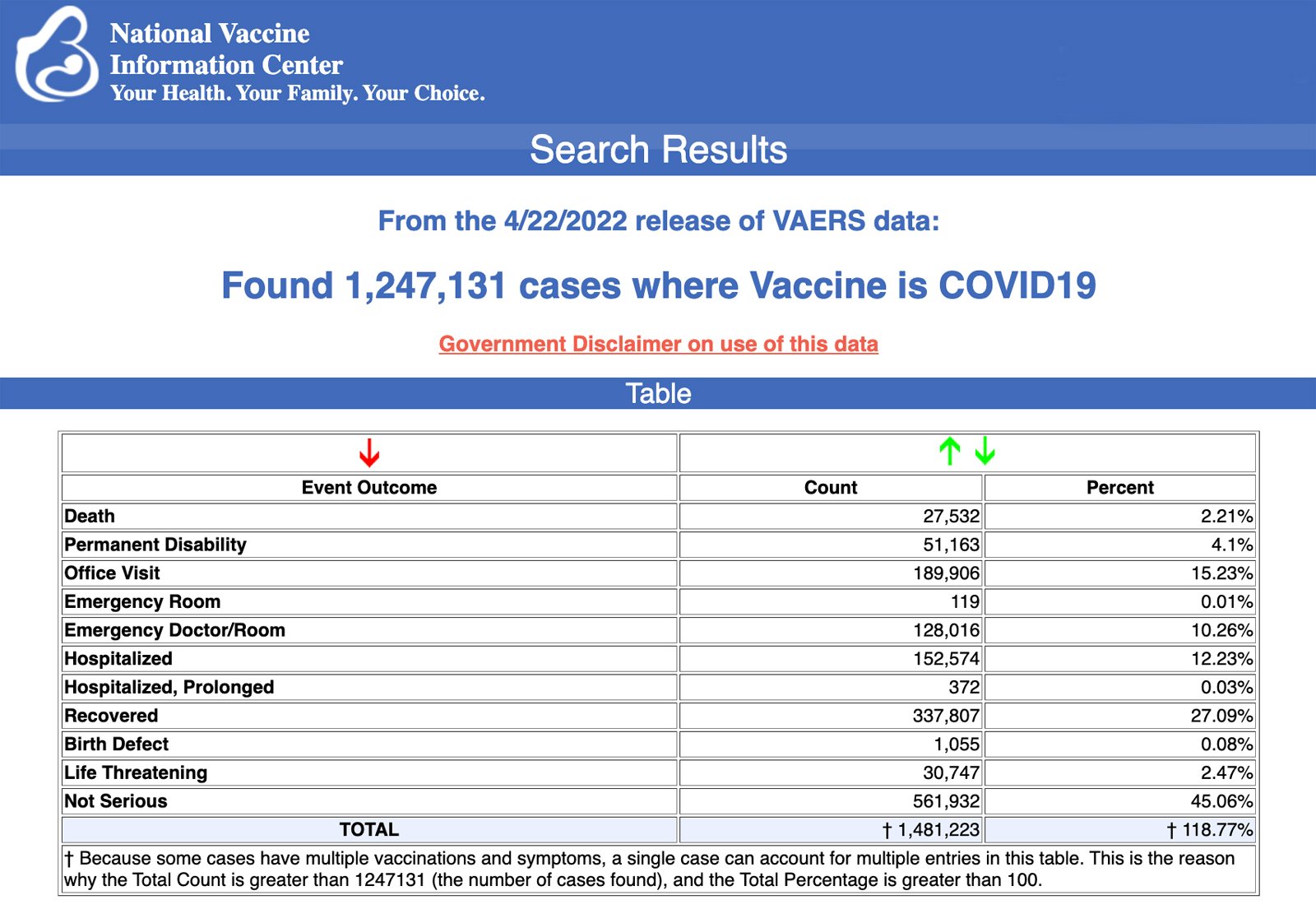
Die Centers for Disease Control and Prevention (CDC) haben heute neue Daten veröffentlicht, aus denen hervorgeht, dass zwischen dem 14. Dezember 2020 und dem 22. April 2022 insgesamt 1.247.131 Berichte über unerwünschte Ereignisse im Zusammenhang mit COVID-19-Impfstoffen an das Vaccine Adverse Event Reporting System (VAERS) übermittelt wurden. VAERS ist das wichtigste von der Regierung finanzierte System zur Meldung von Impfschäden in den USA.
Die Daten umfassen insgesamt 27.532 Meldungen über Todesfälle – ein Anstieg um 183 gegenüber der Vorwoche – und 224.766 schwerwiegende Schädigungen, einschließlich Todesfällen, im gleichen Zeitraum – ein Anstieg um 1.930 gegenüber der Vorwoche.
Ohne „ausländische Meldungen“ an VAERS wurden in den USA zwischen dem 14. Dezember 2020 und dem 22. April 2022 810.171 unerwünschte Ereignisse, darunter 12.672 Todesfälle und 80.743 schwerwiegende Schädigungen, gemeldet.
Berichte aus dem Ausland sind Berichte, die ausländische Tochtergesellschaften an US-Impfstoffhersteller senden. Gemäß den Vorschriften der US-amerikanischen Food and Drug Administration (FDA) muss ein Hersteller, der über einen ausländischen Fall informiert wird, der ein schwerwiegendes Ereignis beschreibt, das nicht auf dem Beipackzettel des Produkts angegeben ist, den Bericht an VAERS übermitteln.
Von den bis zum 22. April gemeldeten 12.672 Todesfällen in den USA traten 16 % innerhalb von 24 Stunden nach der Impfung auf, 20 % innerhalb von 48 Stunden nach der Impfung und 59 % bei Personen, bei denen die Symptome innerhalb von 48 Stunden nach der Impfung auftraten.
In den USA waren bis zum 23. April 572 Millionen COVID-19-Impfdosen verabreicht worden, davon 338 Millionen Dosen von Pfizer, 215 Millionen Dosen von Moderna und 19 Millionen Dosen von Johnson & Johnson (J&J).
Jeden Freitag veröffentlicht VAERS die bis zu einem bestimmten Datum eingegangenen Meldungen über Impfschäden. An VAERS übermittelte Meldungen erfordern weitere Untersuchungen, bevor ein kausaler Zusammenhang bestätigt werden kann.
In der Vergangenheit hat sich gezeigt, dass VAERS nur 1 % der tatsächlichen unerwünschten Ereignisse infolge von Impfungen erfasst.
Die US-VAERS-Daten vom 14. Dezember 2020 bis 22. April 2022 für 5- bis 11-Jährige zeigen:
- 10.348 unerwünschte Ereignisse, darunter 256 als schwerwiegend eingestufte und 5 gemeldete Todesfälle.
- 19 Berichte über Myokarditis und Perikarditis (Herzentzündung).
Die CDC verwenden eine eingeschränkte Falldefinition von „Myokarditis“, die Fälle von Herzstillstand, ischämischen Schlaganfällen und Todesfällen aufgrund von Herzproblemen ausschließt, die auftreten, bevor man die Möglichkeit hat, eine Notaufnahme aufzusuchen. The Defender hat in den vergangenen Wochen festgestellt, dass die CDC mehrere Berichte über Myokarditis und Perikarditis in dieser Altersgruppe aus dem VAERS-System entfernt haben. Es wurde keine Erklärung dafür abgegeben. - 42 Berichte über Blutgerinnungsstörungen.
Die US-VAERS-Daten vom 14. Dezember 2020 bis 22. April 2022 für 12- bis 17-Jährige zeigen:
- 31.455 unerwünschte Ereignisse, darunter 1.803, die als schwerwiegend eingestuft wurden, und 44 gemeldete Todesfälle. Der jüngste gemeldete Todesfall betrifft ein 14-jähriges Mädchen aus Tennessee (VAERS-Identifikationsnummer 2238618), das nach der Verabreichung ihrer zweiten Dosis des Impfstoffs COVID-19 von Pfizer starb. Dem VAERS-Bericht zufolge war das Mädchen bereits an Krebs erkrankt, wurde aber 29 Tage nach der Verabreichung der zweiten Dosis von Pfizer mit einem schweren COVID-19-Verlauf und einer COVID-Pneumonie ins Krankenhaus eingeliefert. Ihr Zustand wurde „lebensbedrohlich“, sie litt unter Atemversagen und Bradykardie und starb in der Folge.
- 65 Berichte über Anaphylaxie bei 12- bis 17-Jährigen, bei denen die Reaktion lebensbedrohlich war, eine Behandlung erforderte oder zum Tod führte – wobei 96 % der Fälle auf den Impfstoff von Pfizer zurückzuführen waren.
- 649 Berichte über Myokarditis und Perikarditis – zwei weniger als in der vergangenen Woche – mit 637 Fällen, die auf den Impfstoff von Pfizer zurückzuführen sind.
- 165 Berichte über Blutgerinnungsstörungen – einer weniger als in der vergangenen Woche – wobei alle Fälle Pfizer zugeschrieben werden.
Das zeigen die VAERS-Daten aus den USA vom 14. Dezember 2020 bis zum 22. April 2022 für alle Altersgruppen zusammen:
- 20 % der Todesfälle standen im Zusammenhang mit kardialen Erkrankungen.
- 54 % der Verstorbenen waren männlich, 41 % weiblich, und bei den übrigen Todesmeldungen wurde das Geschlecht der Verstorbenen nicht angegeben.
- Das durchschnittliche Sterbealter lag bei 73 Jahren.
- Bis zum 22. April meldeten 5.460 schwangere Frauen unerwünschte Ereignisse im Zusammenhang mit COVID-19-Impfstoffen, darunter 1.709 Berichte über Fehl- oder Frühgeburten.
- Von den 3.630 gemeldeten Fällen von Bellscher Parese [Gesichtslähmung] – drei weniger als in der letzten Woche – wurden 51% auf Impfungen von Pfizer, 40% auf Moderna und 8% auf J&J zurückgeführt.
- 870 Berichte über das Guillain-Barré-Syndrom, wobei 42 % der Fälle auf Pfizer, 30 % auf Moderna und 28 % auf J&J zurückzuführen sind.
- 2.343 Berichte über Anaphylaxie – 12 weniger als in der letzten Woche – bei denen die Reaktion lebensbedrohlich war, eine Behandlung erforderte oder zum Tod führte.
- 1.678 Berichte über Myokardinfarkte.
- 13.826 Berichte über Blutgerinnungsstörungen in den USA. Davon wurden 6.199 Berichte Pfizer, 4.925 Berichte Moderna und 2.661 Berichte J&J zugeschrieben.
- 4.152 Fälle von Myokarditis und Perikarditis, wobei 2.544 Fälle auf den Impfstoff von Pfizer, 1.415 Fälle auf den von Moderna und 181 Fälle auf den Impfstoff COVID-19 von J&J zurückzuführen sind.
FDA-Sitzung im Juni zu COVID-19-Impfstoffen für Babys und Kleinkinder
Die FDA wird sich im Juni – entweder am 8., 21. oder 22. Juni – treffen, um über COVID-19-Impfstoffe für Kinder unter 6 Jahren zu diskutieren. Der beratende Ausschuss der Behörde für Impfstoffe wird auf seiner Sitzung im Juni auch den Antrag von Novavax auf eine Notfallzulassung (Emergency Use Authorization, EUA) für den COVID-19-Impfstoff für Erwachsene diskutieren.
Moderna beantragte am Donnerstag bei der FDA die Zulassung des COVID-19-Impfstoffs für den Notfalleinsatz bei Kindern im Alter von 6 Monaten bis 6 Jahren.
Das Unternehmen führte separate Studien für zwei Versionen des Impfstoffs durch, eine für Säuglinge und Kleinkinder von 6 Monaten bis 2 Jahren und eine für Kinder von 2 bis 6 Jahren.
Das Unternehmen behauptete, die Daten zeigten „eine robuste neutralisierende Antikörperreaktion“ und „ein günstiges Sicherheitsprofil“. Nach Ansicht von Experten stellt Moderna jedoch nicht die Daten zur Verfügung, die zur Berechnung des Nutzen-Risiko-Verhältnisses seines COVID-Impfstoffs erforderlich sind.
Die in der Pressemitteilung vom Donnerstag zitierte KidCOVE-Studie von Moderna zeigt, dass der Moderna-Impfstoff die Mindestanforderungen der FDA an die Wirksamkeit von EUA in der Altersgruppe der 2- bis unter 6-Jährigen nicht erfüllt und in der Altersgruppe der 6 Monate bis 2 Jahre alten Kinder die von der Behörde geforderte Wirksamkeit von 50 % nur knapp übertrifft, nachdem der Impfstoffhersteller seine Analyse der Studie geändert hat, um den Grenzwert zu erreichen.
In der jüngeren Altersgruppe lag die Wirksamkeit des Moderna-Impfstoffs nach eigenen Angaben bei 51 %. In der älteren Altersgruppe lag die Wirksamkeit des Impfstoffs bei nur 37 % und damit deutlich unter den Anforderungen der FDA. Dies sind andere Zahlen zur Wirksamkeit als die, die das Unternehmen im letzten Monat gemeldet hat.
Es wird erwartet, dass Pfizer im Mai seinen Antrag für eine dreimalige Impfung mit kleineren Einzeldosen für Kinder unter 5 Jahren einreichen wird.
Gesetzgeber drängen FDA zur COVID-19-Impfung für die jüngsten Altersgruppen
Die Ankündigung von Moderna erfolgte nur wenige Tage, nachdem das House Select Subcommittee on Coronavirus Crisis die FDA um einen aktuellen Statusbericht über COVID-19-Impfstoffe für Kinder unter 5 Jahren gebeten hatte, weil man befürchtete, dass „Millionen von Kleinkindern immer noch ungeschützt sind, weil noch kein Impfstoff für diese Altersgruppe zugelassen wurde“.
Ein hochrangiger FDA-Beamter erklärte am Dienstag gegenüber der New York Times, dass die Behörde einen COVID-19-Impfstoff für die jüngste Altersgruppe nicht zugelassen hat, weil Pfizer und Moderna ihre Zulassungsanträge noch nicht fertig gestellt haben.
Die Behörde gab letzte Woche an, sie erwäge, die Prüfung des Antrags von Moderna auf Zulassung des COVID-19-Impfstoffs für Kinder unter 5 Jahren zu verschieben, bis ihr Daten von Pfizer und BioNTech über deren Impfstoff für Kinder vorliegen, wodurch sich die frühestmögliche Zulassung eines Impfstoffs von Mai auf Juni verschiebt.
Die FDA erklärte, es sei einfacher und weniger verwirrend, zwei Impfstoffe gleichzeitig zuzulassen und in der Öffentlichkeit zu bewerben, als einen Impfstoff schneller zuzulassen und den anderen erst später.
Die Beamten der Behörde befürchteten, den Impfstoff von Moderna zu genehmigen, nur um wenige Wochen später vielleicht festzustellen, dass der Impfstoff von Pfizer einen besseren Schutz bietet.
Pfizer beantragt EUA für eine Boosterdosis für 5- bis 11-Jährige
Pfizer und BioNTech gaben am Dienstag bekannt, dass sie die Notfallzulassung für eine COVID-19-Boosterdosis für Kinder zwischen 5 und 11 Jahren beantragt haben. In einer Pressemitteilung zitierte Pfizer Daten aus seiner Phase-2/3-Studie, die besagen, dass eine dritte Dosis eine „starke Immunreaktion“ in der jüngeren Altersgruppe hervorruft, wenn sie sechs Monate nach der zweiten Dosis verabreicht wird.
Die Daten basierten auf einer kleinen Studie, an der nur 140 Kinder im Alter von 5 bis 11 Jahren teilnahmen, die sechs Monate nach der zweiten Dosis des COVID-Impfstoffs von Pfizer-BioNTech als Teil der Primärserie eine Boosterdosis erhielten.
Pfizer gab an, dass 30 Kinder, die an der Studie teilnahmen, einen 36-fachen Anstieg der Antikörper gegen das Virus aufwiesen – Werte, die hoch genug sind, um die Omikron-Variante zu bekämpfen, die derzeit nicht die vorherrschende Variante in den USA ist.
Experten erklärten gegenüber The Defender, dass „die klinische Studie, die zur Untermauerung der Idee einer COVID-19-Auffrischungsimpfung für 5- bis 11-Jährige herangezogen wird, völlig unzureichend ist, um eine solche Empfehlung auszusprechen“.
Dänemark setzt COVID-19-Impfkampagne aus
Dänemark hat am Dienstag als erstes Land seine nationale COVID-19-Impfkampagne ausgesetzt, nachdem die Gesundheitsbehörden erklärt hatten, die Pandemie sei dort unter Kontrolle.
Bolette Soborg, Direktorin der Abteilung für Infektionskrankheiten der dänischen Gesundheitsbehörde, erklärte, Dänemark lasse das Massenimpfungsprogramm „auslaufen“ und würde nach dem 15. Mai keine Einladungen zu Impfungen mehr verschicken.
Die Gesundheitsbehörden führten mehrere Faktoren an, die zu der Entscheidung beigetragen haben, die nationale Impfkampagne zu beenden. Dazu gehören ein Rückgang der Zahl der neu gemeldeten Infektionen, stabilisierte Hospitalisierungsraten und eine insgesamt hohe Durchimpfungsrate.
Dänemark plant, das Impfprogramm im Herbst wieder aufzunehmen, wobei zuvor eine gründliche fachliche Bewertung vorgenommen werden soll, wer, wann und mit welchen Impfstoffen geimpft werden soll.
Die Entscheidung kommt nur wenige Monate nachdem Dänemark als erster Mitgliedstaat der Europäischen Union alle COVID-19-bezogenen Beschränkungen aufgehoben hat.
Children’s Health Defense bittet jeden, der eine unerwünschte Nebenwirkung erlitten hat, egal durch welchen Impfstoff, eine Meldung nach den folgenden drei Schritten einzureichen.