Os Centros de Controle e Prevenção de Doenças (CDC) divulgaram hoje novos dados mostrando um total de 1.247.131 notificações de eventos adversos após as vacinas COVID-19 enviadas entre 14 de dezembro de 2020 e 22 de abril de 2022 ao Sistema de Notificação de Eventos Adversos de Vacinas (VAERS). O VAERS é o principal sistema financiado pelo governo para relatar reações adversas a vacinas nos EUA.
Os dados incluíram um total de 27.532 relatos de mortes – um aumento de 183 em relação à semana anterior – e 224.766 ferimentos graves, incluindo mortes, durante o mesmo período – um aumento de 1.930 em comparação com a semana anterior.
Excluindo “relatos estrangeiros” ao VAERS, 810.171 eventos adversos, incluindo 12.672 mortes e 80.743 ferimentos graves, foram relatados nos EUA entre 14 de dezembro de 2020 e 22 de abril de 2022.
Os relatórios estrangeiros são relatórios que as subsidiárias estrangeiras enviam aos fabricantes de vacinas dos EUA. De acordo com os regulamentos da Food and Drug Administration (FDA) dos EUA, se um fabricante for notificado de um relatório de caso estrangeiro que descreva um evento que seja grave e não apareça na rotulagem do produto, o fabricante é obrigado a enviar o relatório ao VAERS.
Das 12.672 mortes nos EUA relatadas em 22 de abril, 16% ocorreram dentro de 24 horas após a vacinação, 20% ocorreram dentro de 48 horas após a vacinação e 59% ocorreram em pessoas que apresentaram o início dos sintomas dentro de 48 horas após a vacinação.
Nos EUA, 572 milhões de doses de vacina COVID-19 foram administradas até 23 de abril, incluindo 338 milhões de doses de Pfizer, 215 milhões de doses de Moderna e 19 milhões de doses de Johnson & Johnson (J&J).
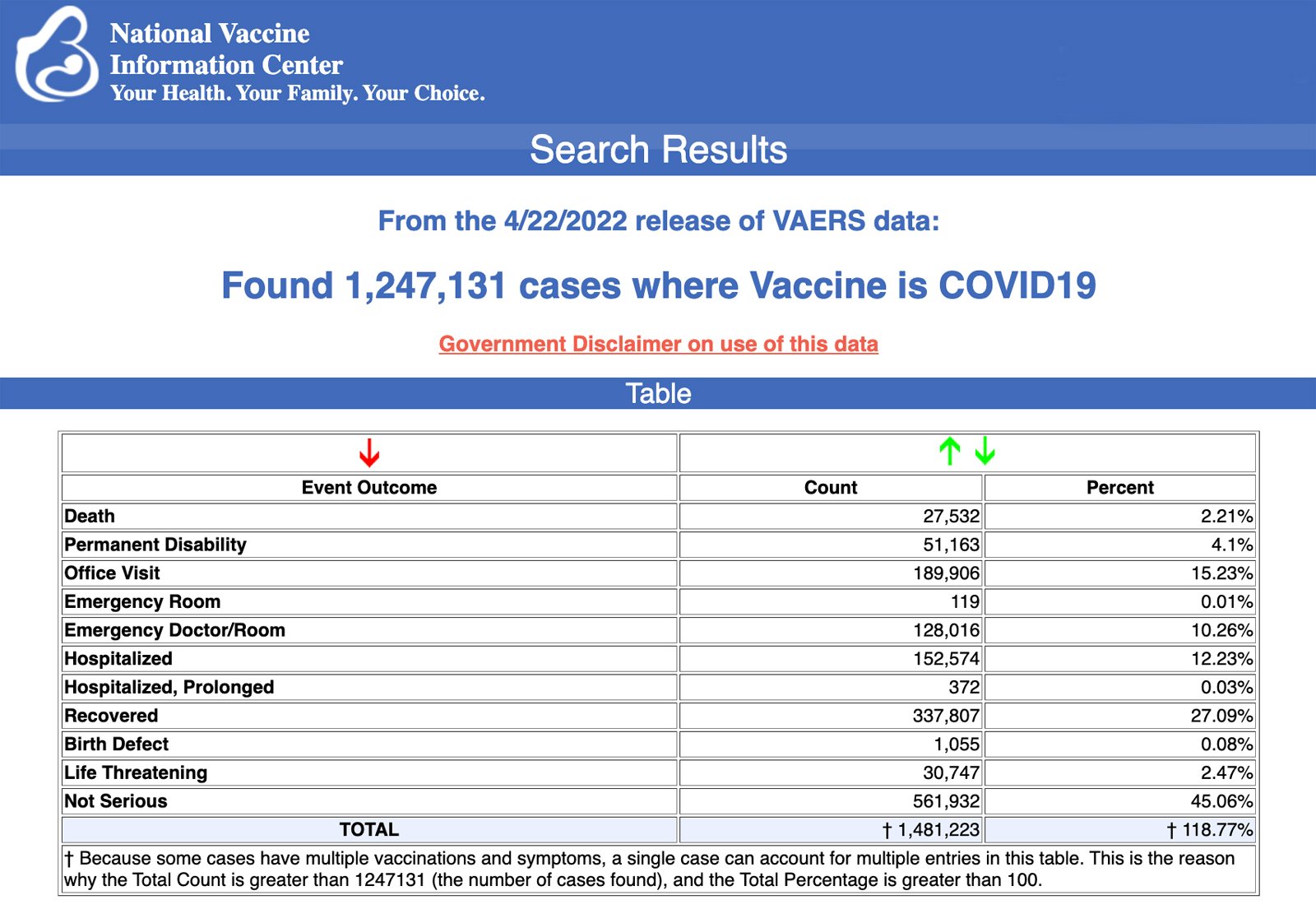
Toda sexta-feira, o VAERS publica relatórios de lesões de vacinas recebidos em uma data especificada. Os relatórios enviados ao VAERS requerem investigação adicional antes que uma relação causal possa ser confirmada.
Historicamente, o VAERS demonstrou relatar apenas 1% dos eventos adversos reais da vacina.
Os dados do VAERS dos EUA de 14 de dezembro de 2020 a 22 de abril de 2022 para crianças de 5 a 11 anos mostram:
- 10.348 eventos adversos, incluindo 256 classificados como graves e 5 óbitos relatados.
- 19 relatos de miocardite e pericardite (inflamação do coração).
Os CDC usam uma definição de caso restrita de “miocardite”, que exclui casos de parada cardíaca, acidente vascular cerebral isquêmico e mortes devido a problemas cardíacos que ocorrem antes de se ter a chance de ir ao pronto-socorro. relatos de miocardite e pericardite foram removidos pelos CDC do sistema VAERS nesta faixa etária. Nenhuma explicação foi fornecida. - 42 relatos de distúrbios de coagulação do sangue.
Os dados do VAERS dos EUA de 14 de dezembro de 2020 a 22 de abril de 2022 para jovens de 12 a 17 anos mostram:
- 31.455 eventos adversos, incluindo 1.803 classificados como graves e 44 mortes relatadas. A morte mais recente relatada envolve uma menina de 14 anos do Tennessee (VAERS ID 2238618 ) que morreu após receber sua segunda dose da vacina COVID-19 da Pfizer. De acordo com o relatório do VAERS, a menina tinha histórico anterior de câncer, mas foi hospitalizada 29 dias depois de receber sua segunda dose de Pfizer com COVID-19 grave e pneumonia por COVID. Ela ficou “criticamente doente”, desenvolveu insuficiência respiratória e bradicardia e depois morreu.
- 65 relatos de anafilaxia entre jovens de 12 a 17 anos, onde a reação foi fatal, exigiu tratamento ou resultou em morte – com 96% dos casos atribuídos à vacina da Pfizer.
- 649 relatos de miocardite e pericardite – dois a menos que na semana passada – com 637 casos atribuídos à vacina da Pfizer.
- 165 relatos de distúrbios de coagulação do sangue – 1 a menos do que na semana passada – com todos os casos atribuídos à Pfizer.
Os dados VAERS dos EUA de 14 de dezembro de 2020 a 22 de abril de 2022, para todas as faixas etárias combinadas, mostram:
- 20% das mortes foram relacionadas a distúrbios cardíacos.
- 54% dos que morreram eram do sexo masculino, 41% do sexo feminino e os restantes relatórios de óbitos não incluíam o sexo do falecido.
- A idade média da morte foi de 73 anos.
- Em 22 de abril, 5.460 mulheres grávidas relataram eventos adversos relacionados às vacinas COVID-19, incluindo 1.709 notificações de aborto espontâneo ou parto prematuro.
- Dos 3.630 casos de paralisia de Bell relatados – três a menos do que na semana passada – 51% foram atribuídos às vacinas da Pfizer, 40% à Moderna e 8% à J&J.
- 870 relatos de síndrome de Guillain-Barré, com 42% dos casos atribuídos à Pfizer, 30% à Moderna e 28% à J&J.
- 2.343 notificações de anafilaxia – 12 notificações a menos do que na semana passada – onde a reação foi fatal, exigiu tratamento ou resultou em morte.
- 1.678 notificações de infarto do miocárdio.
- 13.826 notificações de distúrbios de coagulação do sangue nos EUA Desses, 6.199 notificações foram atribuídas à Pfizer, 4.925 notificações à Moderna e 2.661 notificações à J&J.
- 4.152 casos de miocardite e pericardite com 2.544 casos atribuídos à Pfizer, 1.415 casos à Moderna e 181 casos à vacina COVID-19 da J&J.
FDA se reunirá em junho sobre vacinas COVID-19 para bebês e crianças
A FDA se reunirá em junho – 8, 21 ou 22 de junho – para discutir vacinas COVID-19 para crianças menores de 6 anos. O comitê consultivo de vacinas da agência durante sua reunião de junho também discutirá sobre o pedido de Autorização do Uso de Emergência (AUE) para a vacina Novavax COVID-19 para adultos.
A Moderna pediu na quinta-feira à FDA que autorizasse sua vacina COVID-19 para uso emergencial para crianças de 6 meses a 6 anos.
A empresa realizou testes separados para duas versões da vacina, uma para bebês e crianças de 6 meses a 2 anos e outra para crianças de 2 a 6 anos.
A empresa afirmou que os dados mostraram “uma resposta robusta de anticorpos neutralizantes” e “um perfil de segurança favorável”. Mas especialistas dizem que a Moderna não está fornecendo os dados necessários para calcular o risco-benefício de sua vacina COVID.
O estudo KidCOVE da Moderna citado no comunicado de imprensa de quinta-feira mostra que a injeção da Moderna não atendeu aos requisitos mínimos de eficácia da FDA para EUA na faixa etária de 2 a menos de 6 anos e mal superou o requisito de eficácia de 50% da agência no período de 6 meses a 2 anos. faixa etária de um ano depois que o fabricante da vacina mudou sua análise do estudo para atingir o limite.
Na faixa etária mais jovem, a Moderna disse que a eficácia de sua vacina foi de 51%. Na faixa etária mais avançada, a eficácia da vacina foi de apenas 37% – substancialmente menor do que a exigência do FDA. Estes são números de eficácia diferentes daqueles que a empresa relatou no mês passado.
Espera-se que a Pfizer apresente seu pedido em maio para uma vacinação de três doses usando doses individuais menores para crianças menores de 5 anos.
Legisladores pressionam FDA em vacinas COVID-19 para faixas etárias mais jovens
O anúncio da Moderna ocorreu apenas alguns dias depois que o Subcomitê Selecionado da Câmara sobre Crise de Coronavírus pediu à FDA uma atualização de status das vacinas COVID-19 para crianças menores de 5 anos por preocupações de que “milhões de crianças ainda permanecem desprotegidas porque nenhuma vacina ainda foi autorizada” para essa idade grupo.
Um alto funcionário da FDA disse na terça-feira ao The New York Times que a agência não liberou uma vacina COVID-19 para a faixa etária mais jovem porque a Pfizer e a Moderna não concluíram seus pedidos de autorização.
A agência disse na semana passada que está considerando adiar a revisão do pedido da Moderna para autorizar sua vacina COVID-19 para crianças menores de 5 anos até que tenha dados da Pfizer e BioNTech sobre sua vacina para crianças, empurrando a autorização mais cedo possível de uma vacina de maio a Junho.
A FDA disse que seria mais simples e menos confuso autorizar e promover simultaneamente duas vacinas ao público, em vez de autorizar uma em um cronograma mais rápido e a outra no futuro.
Os funcionários da agência estavam preocupados em autorizar a vacina da Moderna apenas para descobrir apenas algumas semanas depois que a Pfizer oferecia melhor proteção.
Pfizer solicita EUA para dose de reforço para crianças de 5 a 11 anos
A Pfizer e a BioNTech anunciaram na terça-feira que solicitaram aos EUA uma dose de reforço COVID -19 para crianças de 5 a 11 anos. No comunicado de imprensa, Pfizer citou os dados da Fase 2/3 do trial que reivindicou uma terceira dose, produziu uma “resposta imune forte ” na faixa etária mais jovem quando administrado seis meses após a segunda dose.
Os dados foram baseados em um pequeno estudo envolvendo apenas 140 crianças de 5 a 11 anos que receberam uma dose de reforço seis meses após a segunda dose da vacina COVID da Pfizer-BioNTech como parte da série primária.
A Pfizer disse que 30 crianças que participaram do estudo revelaram um aumento de 36 vezes nos anticorpos que combatem o vírus – níveis altos o suficiente para combater a variante Omicron, que atualmente não é a variante dominante nos EUA.
Especialistas disseram ao The Defender que “o ensaio clínico usado para apoiar a noção de um reforço COVID-19 para crianças de 5 a 11 anos é totalmente inadequado para fazer tal recomendação”.
Dinamarca suspende campanha de vacina contra COVID-19
A Dinamarca se tornou na terça-feira o primeiro país a suspender sua campanha nacional de vacina contra a COVID-19 depois que autoridades de saúde disseram que a pandemia está sob controle no país.
Bolette Soborg, diretora do departamento de doenças infecciosas da Autoridade de Saúde Dinamarquesa, disse que a Dinamarca está “encerrando” o programa de vacinação em massa e que os convites para vacinações não serão mais emitidos após 15 de maio.
As autoridades de saúde pública citaram vários fatores que contribuíram para a decisão de encerrar a campanha nacional de vacinação. Estes incluem um declínio no número de infecções recentemente relatadas, taxas de hospitalização estabilizadas e um alto nível geral de vacinação.
A Dinamarca planeja reabrir o programa de vacinação no outono, que será precedido por uma avaliação profissional completa de quem e quando vacinar e com quais vacinas.
A decisão vem apenas alguns meses depois que a Dinamarca eliminou todas as restrições relacionadas ao COVID-19, tornando-se o primeiro estado membro da União Europeia a fazê-lo.
A Children’s Health Defense pede a qualquer pessoa que tenha sofrido uma reação adversa, a qualquer vacina, que registre um boletim de ocorrência seguindo estas três etapas.