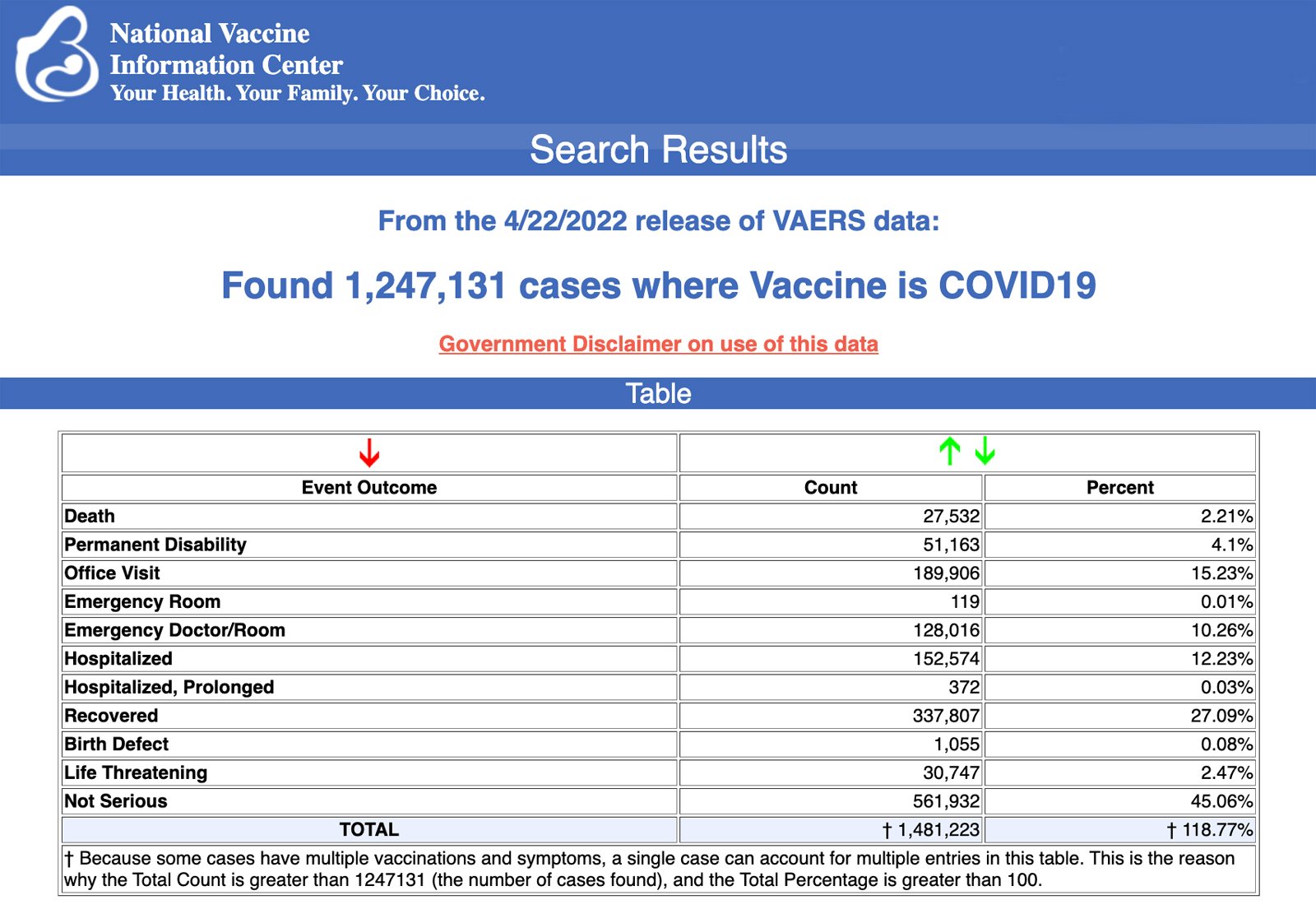
Les Centres de contrôle et de prévention des maladies (CDC) ont publié aujourd’hui de nouvelles données montrant qu’un total de 1 247 131 rapports d’effets indésirables suite à l’administration des vaccins COVID-19 ont été soumis entre le 14 décembre 2020 et le 22 avril 2022 au Vaccine Adverse Event Reporting System (VAERS). Le VAERS est le principal système financé par le gouvernement pour signaler les réactions indésirables aux vaccins aux États-Unis.
Les données comprennent un total de 27 532 rapports de décès – soit une augmentation de 183 par rapport à la semaine précédente – et 224 766 blessures graves, dont des décès, au cours de la même période – soit une augmentation de 1 930 par rapport à la semaine précédente.
Si l’on exclut les «rapports étrangers» au VAERS, 810 171 événements indésirables, dont 12 672 décès et 80 743 blessures graves, ont été signalés aux États-Unis entre le 14 décembre 2020 et le 22 avril 2022.
Les rapports étrangers sont des rapports que les filiales étrangères envoient aux fabricants de vaccins américains. En vertu de la réglementation de la Food and Drug Administration (FDA) des États-Unis, si un fabricant est informé d’un rapport de cas étranger décrivant un effet à la fois grave et ne figurant pas sur l’étiquetage du produit, il est tenu de soumettre le rapport au VAERS.
Sur les 12 672 décès signalés aux États-Unis au 22 avril, 16 % sont survenus dans les 24 heures suivant la vaccination, 20 % dans les 48 heures suivant la vaccination et 59 % chez des personnes ayant présenté des symptômes dans les 48 heures suivant la vaccination.
Aux États-Unis, 572 millions de doses de vaccin COVID-19 avaient été administrées au 23 avril, dont 338 millions de doses de Pfizer, 215 millions de doses de Moderna et 19 millions de doses de Johnson & Johnson (J&J).
Chaque vendredi, le VAERS publie les rapports de blessures (effets indésirables) liées aux vaccins reçus à une date précise. Les rapports soumis au VAERS nécessitent une enquête plus approfondie avant qu’une relation de cause à effet puisse être confirmée.
Historiquement, il a été démontré que le VAERS ne rapporte que 1 % des effets indésirables réels des vaccins.
Les données VAERS américaines du 14 décembre 2020 au 22 avril 2022, pour les enfants de 5 à 11 ans, montrent :
- 10 348 d’effets indésirables, dont 256 qualifiés de graves et 5 décès signalés.
- 19 rapports de myocardite et de péricardite (inflammation du cœur).
Les CDC utilise une définition de cas restreinte de « myocardite », qui exclut les cas d’arrêts cardiaques, les accidents vasculaires cérébraux ischémiques et les décès causés par des problèmes cardiaques qui surviennent avant qu’on puisse se rendre aux urgences. Le « The Defender » a remarqué au cours des semaines précédentes que plusieurs rapports demyocardite et de péricardite ont été retirés par le CDC du système VAERS dans cette tranche d’âge. Aucune explication n’a été donnée. - 42 rapports de troubles de la coagulation sanguine.
Les données VAERS américaines du 14 décembre 2020 au 22 avril 2022, pour les jeunes de 12 à 17 ans, montrent :
- 31 455 effets indésirables, dont 1 803 graves et 44 décès ont été signalés. Le décès le plus récent concerne une jeune fille de 14 ans du Tennessee (VAERS I.D. 2238618) qui est décédée après avoir reçu sa deuxième dose du vaccin COVID-19 de Pfizer. Selon le rapport VAERS, la jeune fille avait des antécédents de cancer mais a été hospitalisée 29 jours après avoir reçu sa deuxième dose de Pfizer pour une pneumonie sévère due à la COVID-19. Elle est devenue « gravement malade », a développé une insuffisance respiratoire et une bradycardie et est décédée par la suite.
- 65 rapports d’anaphylaxie chez des jeunes de 12 à 17 ans, dans lesquels la réaction mettait en danger la vie du patient, nécessitait un traitement ou entraînait la mort – avec 96 % des cas étant attribués au vaccin de Pfizer.
- 649 rapports de myocardite et de péricardite – deux de moins que la semaine dernière – dont 637 cas attribués au vaccin de Pfizer.
- 165 rapports de troubles de la coagulation sanguine – 1 de moins que la semaine dernière – avec tous les cas attribués à Pfizer.
Les données VAERS américaines du 14 décembre 2020 au 22 avril 2022, tous groupes d’âge confondus, montrent :
- 20 % des décès étaient liés à des troubles cardiaques.
- 54 % des personnes décédées étaient des hommes, 41 % étaient des femmes et les autres rapports de décès n’indiquaient pas le sexe de la personne décédée.
- L’âge moyen du décès était de 73 ans.
- Au 22 avril, 5 460 femmes enceintes ont signalé des effets indésirables liés aux vaccins COVID-19, dont 1 709 rapports de fausse couche ou de naissance prématurée.
- Sur les 3 630 cas de paralysie de Bell signalés – soit trois de moins que la semaine dernière – 51 % ont été attribués aux vaccins Pfizer, 40 % à Moderna et 8 % à J&J.
- 870 rapports de syndrome de Guillain-Barré, dont 42% des cas attribués à Pfizer, 30% à Moderna et 28% à J&J.
- 2 343 rapports d’anaphylaxie – 12 rapports de moins que la semaine dernière – où la réaction a mis la vie en danger, a nécessité un traitement ou a entraîné la mort.
- 1 678 rapports d’ infarctus du myocarde.
- 13 826 rapports de troubles de la coagulation sanguine aux États-Unis. Parmi ceux-ci, 6 199 rapports ont été attribués à Pfizer, 4 925 à Moderna et 2 661 à J&J.
- 4 152 cas de myocardite et de péricardite, dont 2 544 cas attribués au vaccin COVID-19 de Pfizer, 1 415 cas à celui de Moderna et 181 cas à celui de J&J.
La FDA se réunira en juin sur les vaccins COVID-19 pour les bébés et les jeunes enfants
La FDA se réunira en juin – soit les 8, 21 ou 22 juin – pour discuter des vaccins COVID-19 destinés aux enfants de moins de 6 ans. Lors de sa réunion de juin, le comité consultatif sur les vaccins de l’agence examinera également la demande d’autorisation d’utilisation d’urgence (EUA) de Novavax pour son vaccin COVID-19 destiné aux adultes.
Moderna a demandé jeudi à la FDA d’autoriser son vaccin COVID-19 pour une utilisation d’urgence pour les enfants âgés de 6 mois à 6 ans.
La société a mené des essais séparés pour deux versions du vaccin, l’une pour les nourrissons et les jeunes enfants de 6 mois à 2 ans, et l’autre pour les enfants de 2 à 6 ans.
La société a affirmé que les données ont montré « une réponse robuste des anticorps neutralisants » et « un profil de sécurité favorable ». Mais les experts affirment que Moderna ne fournit pas les données nécessaires pour calculer le rapport risque-bénéfice de son vaccin COVID.
L’étude de Moderna nommée KidCOVE citée dans le communiqué de presse de jeudi montre que l’injection Moderna n’a pas satisfait aux exigences minimales d’efficacité de la FDA pour l’EUA dans le groupe d’âge des 2 à 6 ans, et qu’elle a à peine dépassé les exigences de l’agence. Le fabricant du vaccin a modifié son analyse de l’étude pour atteindre le seuil d’efficacité de 50 % dans le groupe d’âge de 6 mois à 2 ans.
Dans le groupe d’âge plus jeune, Moderna a déclaré que l’efficacité de son vaccin était de 51%. Dans le groupe d’âge supérieur, l’efficacité du vaccin n’était que de 37 %, soit nettement moins que ce qu’exige la FDA. Ces chiffres sur l’efficacité sont différents de ceux que la société a publiés le mois dernier.
Pfizer devrait déposer en mai sa demande pour une vaccination à trois doses utilisant des doses individuelles plus petites pour les enfants de moins de 5 ans.
Les législateurs font pression sur la FDA concernant les vaccins COVID-19 pour les groupes d’âge les plus jeunes.
L’annonce de Moderna a été faite quelques jours après que le House Select Subcommittee on Coronavirus Crisis a demandé à la FDA de faire le point sur les vaccins COVID-19 destinés aux enfants de moins de 5 ans, car « des millions de jeunes enfants ne sont toujours pas protégés car aucun vaccin n’a encore été autorisé » pour cette tranche d’âge.
Mardi dernier, un haut responsable de la FDA a déclaré au New York Timesque l’agence n’avait pas autorisé le vaccin COVID-19 pour le groupe d’âge le plus jeune parce que Pfizer et Moderna n’ont pas terminé leurs demandes d’autorisation.
L’agence a déclaré la semaine dernière qu’elle envisageait de reporter l’examen de la demande de Moderna d’autoriser son vaccin COVID-19 pour les enfants de moins de 5 ans jusqu’à ce qu’elle dispose des données de Pfizer et BioNTech sur leur vaccin pour enfants, ce qui repousse de mai à juin l’autorisation la plus précoce possible d’un vaccin.
La FDA a déclaré qu’il serait plus simple et moins déroutant d’autoriser et de promouvoir simultanément deux vaccins auprès du public, plutôt que d’en approuver un plus rapidement et l’autre plus tard.
Les responsables de l’Agence craignaient d’autoriser le vaccin de Moderna pour découvrir quelques semaines plus tard que celui de Pfizer offrait une meilleure protection.
Pfizer demande l’autorisation de l’UE pour une dose de rappel pour les enfants de 5 à 11 ans.
Mardi dernier, Pfizer et BioNTech ont annoncé qu’ils avaient déposé une demande d’autorisation européenne pour une dose de rappel de COVID-19 destinée aux enfants âgés de 5 à 11 ans. Dans un communiqué de presse, Pfizer a cité les données de son essai de phase 2/3 selon lesquelles une troisième dose produisait une « forte réponse immunitaire » dans le groupe d’âge le plus jeune lorsqu’elle était administrée six mois après la deuxième dose.
Ces données sont basées sur une petite étude portant sur 140 enfants âgés de 5 à 11 ans qui ont reçu une dose de rappel six mois après la deuxième dose du vaccin COVID de Pfizer-BioNTech dans le cadre de la série primaire.
Selon Pfizer, les 30 enfants qui ont participé à l’étude ont présenté un taux d’anticorps anti-virus 36 fois plus élevé, soit des niveaux suffisamment élevés pour combattre la variante Omicron, qui n’est pas actuellement la variante dominante aux États-Unis.
Les experts ont déclaré au Defender que « l’essai clinique utilisé pour soutenir l’idée d’un rappel de COVID-19 pour les enfants de 5 à 11 ans est totalement inadéquat pour faire une telle recommandation ».
Le Danemark suspend la campagne de vaccination contre la COVID-19
Mardi dernier, le Danemark est devenu le premier pays à suspendre sa campagne nationale de vaccination contre la COVID-19 après que les responsables de la santé ont déclaré que la pandémie y était sous contrôle.
Bolette Soborg, directrice du département des maladies infectieuses de l’autorité sanitaire danoise, a déclaré que le Danemark « mettait fin » au programme de vaccination de masse et que les invitations à se faire vacciner ne seraient plus envoyées après le 15 mai.
Les autorités de santé publique ont cité plusieurs facteurs ayant contribué à la décision de mettre fin à la campagne nationale de vaccination. Il s’agit notamment d’une baisse du nombre d’infections nouvellement signalées, d’une stabilisation des taux d’hospitalisation et d’un niveau de vaccination globalement élevé.
Le Danemark prévoit de rouvrir le programme de vaccination à l’automne, ce qui sera précédé d’une évaluation professionnelle approfondie pour déterminer qui et quand vacciner, et avec quels vaccins.
Cette décision intervient quelques mois seulement après que le Danemark a éliminé toutes les restrictions liées à la COVID-19, devenant ainsi le premier État membre de l’Union européenne à le faire.
Children’s Health Defense demande à toute personne ayant subi un effet indésirable, quel que soit le vaccin, de remplir un rapport en suivant ces trois étapes.