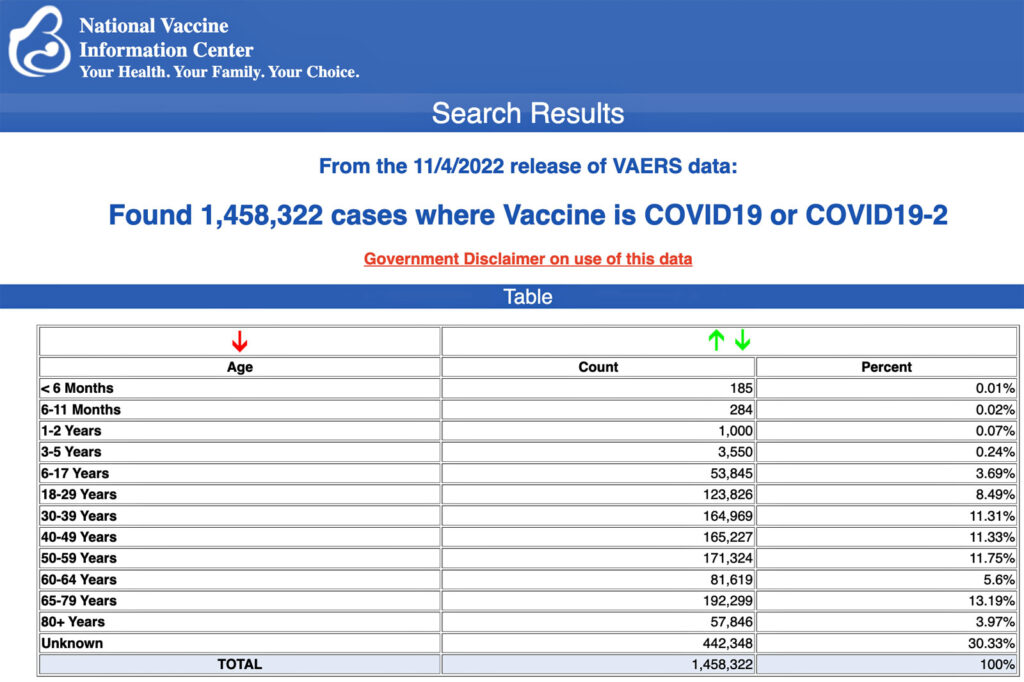
Les Centres de contrôle et de prévention des maladies (CDC) ont publié aujourd’hui de nouvelles données montrant qu’un total de 1 458 322 rapports d’événements indésirables après les vaccins contre la COVID-19 ont été soumis entre le 14 décembre 2020 et le 4 novembre 2022 au Vaccine Adverse Event Reporting System (VAERS).
Le VAERS est le principal système financé par le gouvernement pour signaler les réactions indésirables aux vaccins aux États-Unis.
Les données comprennent un total de 31 961 rapports de décès et 265 274 blessures graves, dont des décès, au cours de la même période.
Au 4 novembre 2022, 7 783 rapports d’effets indésirables avaient été signalés à la suite du nouveau rappel bivalent contre la COVID-19, 45 % étant attribués au rappel de Moderna et 55 % à celui de Pfizer/BioNTech. Les données comprenaient un total de 61 décès et 434 blessures graves.
Au 10 novembre, 31,4 millions de personnes avaient reçu la nouvelle dose de rappel bivalente.
Sur les 31 961 décès signalés, 20 381 cas sont attribués au vaccin contre la COVID-19 de Pfizer, 8 696 cas à Moderna, 2 773 cas à Johnson & Johnson (J&J) et aucun cas n’a encore été signalé pour Novavax.
Si l’on exclut les « rapports étrangers » au VAERS, 894 850 événements indésirables, dont 15 096 décès et 93 362 blessures graves, ont été signalés aux États-Unis entre le 14 décembre 2020 et le 4 novembre 2022.
Les rapports étrangers sont des rapports que les filiales étrangères envoient aux fabricants de vaccins américains. En vertu de la réglementation de la Food and Drug Administration (FDA) des États-Unis, si un fabricant est informé d’un rapport de cas étranger décrivant un effet à la fois grave et ne figurant pas sur l’étiquetage du produit, il est tenu de soumettre le rapport au VAERS.
Sur les 15 096 décès signalés au 4 novembre, 7 % sont survenus dans les 24 heures suivant la vaccination et 15 % dans les 48 heures suivant la vaccination.
Aux Etats-Unis, 640 millions de doses de vaccin contre la COVID-19 avaient été administrées au 2 novembre, dont 381 millions de doses de Pfizer, 241 millions de doses de Moderna et 19 millions de doses de J&J.
Chaque vendredi, le VAERS publie les rapports de blessures liées aux vaccins reçus à une date précise. Les rapports soumis à VAERS nécessitent une enquête plus approfondie avant qu’une relation de cause à effet puisse être confirmée. Historiquement, il a été démontré que le VAERS ne rapporte que 1 % des effets indésirables réels des vaccins.
Les données VAERS du 14 décembre 2020 au 4 novembre 2022, pour les enfants âgés de 6 mois à 5 ans, montrent :
- 5 rapports de myocardite et de péricardite (inflammation du cœur).
Les CDC utilisent une définition restreinte de la « myocardite », qui exclut les cas d’arrêts cardiaques, d’accidents vasculaires cérébraux ischémiques et de décès dus à des problèmes cardiaques qui surviennent avant que l’on ait la possibilité de se rendre aux urgences.
- 28 rapports de troubles de la coagulation sanguine.
- 48 rapports de saisies.
Les données VAERS du 14 décembre 2020 au 4 novembre 2022 pour les enfants de 5 à 11 ans montrent :
- 15 492 événements indésirables, dont 711 qualifiés de graves et 31 décès signalés.
- 48 rapports de myocardite et de péricardite.
- 72 rapports de troubles de la coagulation sanguine.
- 186 rapports de saisies.
Le dernier décès signalé dans ce groupe d’âge est celui d’un garçon de 10 ans qui est mort subitement six jours après avoir reçu une troisième dose du vaccin contre la COVID-19 de Moderna. Selon le rapport, « on ignore si une autopsie a été pratiquée ».
Selon le commentaire de la société (Moderna) inclus dans le rapport, « la cause du décès a été signalée comme étant un arrêt cardiorespiratoire. Les informations concernant l’évaluation clinique, les tests de diagnostic, le traitement fourni ou les rapports d’autopsie n’ont pas été divulguées ».
Les données VAERS du 14 décembre 2020 au 4 novembre 2022 pour les jeunes de 12 à 17 ans montrent :
Selon le CDC, « les données VAERS disponibles au public ne comprennent que les données du rapport initial au VAERS. Les données actualisées qui contiennent les données des dossiers médicaux et les corrections signalées pendant le suivi sont utilisées par le gouvernement pour l’analyse. Cependant, pour de nombreuses raisons, dont la cohérence des données, ces données modifiées ne sont pas disponibles pour le public. »
- 269 rapports d’anaphylaxie chez des jeunes de 12 à 17 ans, dans lesquels la réaction a mis la vie en danger, a nécessité un traitement ou a entraîné la mort.
- 1 336 rapports de myocardite et de péricardite, dont 1 167 cas attribués au vaccin de Pfizer.
- 303 rapports de troubles de la coagulation sanguine, dont 279 cas attribués à Pfizer.
- 27 cas de syndrome de tachycardie orthostatique posturale (POTS), tous attribués au vaccin de Pfizer.
Les données VAERS du 14 décembre 2020 au 4 novembre 2022, tous groupes d’âge confondus, le montrent :
- 16 % des décès étaient liés à des troubles cardiaques.
- 53 % des personnes décédées étaient des hommes, 42 % étaient des femmes et les autres rapports de décès n’indiquaient pas le sexe de la personne décédée.
- L’âge moyen du décès était de 72 ans.
- Au 4 novembre, 8 665 femmes enceintes ont signalé des effets indésirables liés aux vaccins contre la COVID-19, dont 5 051 rapports de fausse couche ou de naissance prématurée.
- Sur les 16 634 cas de paralysie de Bell signalés, 73 % ont été attribués aux vaccins Pfizer, 22 % à Moderna et 5 % à J&J.
- 3 066 rapports de syndrome de Guillain-Barré.
- 10 127 rapports d’anaphylaxie où la réaction a mis la vie en danger, a nécessité un traitement ou a entraîné la mort.
- 4 878 rapports d’ infarctus du myocarde.
- 43 929 rapports de troubles de la coagulation sanguine. Parmi ceux-ci, 30 110 rapports ont été attribués à Pfizer, 9 915 rapports à Moderna et 3 836 rapports à J&J.
- 24 608 cas de myocardite et de péricardite dont 18 514 cas attribués à Pfizer, 5 485 cas à Moderna et 423 cas à J&J.
- 70 cas de maladie de Creutzfeldt-Jakob dont 57 cas attribués à Pfizer, 12 cas à Moderna et 1 cas à J&J.
- 571 cas de POTS dont 421 cas attribués à Pfizer, 129 cas à Moderna et 21 cas à J&J.
La Children’s Health Defense (CHD) demande à toute personne ayant subi un effet indésirable, quel que soit le vaccin, de remplir un rapport en suivant ces trois étapes.
Pfizer et Moderna développent un vaccin à ARNm combiné Omicron-grippe.
Pfizer et Moderna développent une injection combinée contre la COVID-19 et la grippe utilisant l’ARNm codant pour le sous-variant Omicron BA4/BA5 et un nouvel ARNm codant pour les antigènes contenus dans le virus de la grippe.
Comme le composant COVID-19, qui fait l’objet d’une autorisation d’utilisation d’urgence (EUA), a échoué dans les études animales et qu’aucun essai sur l’homme n’a été rapporté, ce composant devrait être écarté dès le départ, selon le Dr Peter A. McCullough.
La combinaison du code génétique de la protéine de pointe du SRAS-CoV-2 et des protéines conservées de la grippe A et B signifierait l’installation du code génétique durable de plusieurs protéines étrangères dans le corps humain.
La production de ces protéines induira une réponse immunitaire continue à plusieurs niveaux qui pourrait créer des effets secondaires amplifiés. L’ARNm codant pour la grippe serait un nouveau produit biologique ne relevant pas de l’EUA et devrait passer par le cycle complet de développement réglementaire de cinq ans pour les produits biologiques génétiques.
Cependant, il semble que les fabricants de vaccins tentent de raccourcir ce cycle de développement en combinant le vaccin contre la grippe non urgente avec le vaccin contre la COVID-19 d’autorisation d’utilisation d’urgence.
Le communiqué de presse de Pfizer sur le nouveau rappel bivalent soulève des questions
Le 4 novembre, Pfizer a annoncé ce que certains médias ont qualifié de « bonnes nouvelles » concernant son rappel bivalent contre la COVID-19, pour lequel la FDA a accordé en août une autorisation de mise sur le marché (EUA) sur la base de tests effectués sur huit souris.
Dans un communiqué de presse, Pfizer a résumé les données actualisées de son essai clinique de phase 2/3 sur le vaccin contre la COVID-19 bivalent Pfizer-BioNTech Omicron BA.4/BA.5-adapté.
En termes simples, le rappel bivalent a multiplié les anticorps contre les sous-lignées Omicron par un facteur de 13,2, alors que le rappel original ne les a multipliés que par un facteur de 2,9. L’augmentation n’a été observée que chez les personnes âgées de plus de 55 ans.
Bien que le nouveau rappel ait produit une augmentation plus modeste (9,5 fois) des anticorps dans le groupe d’âge le plus jeune (18-55 ans), Pfizer a choisi de ne pas indiquer quelle était la réponse dans le groupe d’âge apparié qui avait reçu le rappel original.
Pfizer n’a fourni aucun résultat comparatif dans le groupe des 18-55 ans et aucune différence de résultats cliniques en termes d’infections par COVID-19 – que ce soit dans le communiqué de presse du 4 novembre ou dans un communiqué de presse précédent de Pfizer résumant les données préliminaires.
A quel moment une « augmentation de la réponse en anticorps neutralisants » confère-t-elle une « protection plus forte » ?
Ni BioNTech, qui a coproduit le vaccin contre la COVID-19 de Pfizer/BioNTech, ni la FDA ne le savent – bien qu’ils insistent sur le fait que l’agence a suffisamment de raisons pour cajoler/compeler/contraindre ceux qui ont acquis des anticorps contre le SRAS-CoV-2 lors d’un précédent épisode de COVID-19 à se faire vacciner quand même.
Rutgers annonce un essai sur le vaccin contre la COVID avec Pfizer, alors que l’action en justice contre Rutgers de la CHD progresse
Le 7 novembre, la CHD a déposé un résumé de son appel dans le cadre d’un procès contre l’Université Rutgers concernant le mandat de vaccination contre la COVID-19 de l’université.
L’avocat représentant la CHD et 13 étudiants de l’université Rutgers dans le procès a déclaré que le tribunal de district du New Jersey n’a pas suivi la norme juridique lorsqu’il a rejeté le cas de la CHD.
Dans une interview accordée cette semaine à The Defender,Julio C. Gomez de Gomez LLC, avocat principal dans cette affaire, a déclaré que l’argumentation du juge de district Zahid N. Quraishi, qui a accepté la motion de rejet de l’université, « n’a pas accepté les faits tels qu’ils sont allégués dans la plainte des plaignants comme étant vrais », comme l’exige la norme juridique sur une motion de rejet,.
le 19 octobre la CHD a fait appel de la décision et, le 7 novembre, a déposé un résumé de son appel.
M. Gomez s’est également entretenu avec The Defender au sujet de l’annonce faite par Rutgers, le 4 novembre, de son partenariat avec Pfizer pour un nouvel essai clinique visant à évaluer la sécurité et l’efficacité du vaccin bivalent contre la COVID-19 chez les enfants de moins de 5 ans.
Ce nouvel essai clinique est la dernière preuve en date des conflits d’intérêts de Rutgers liés à ses politiques en matière de vaccins contre la COVID-19, a déclaré M. Gomez.