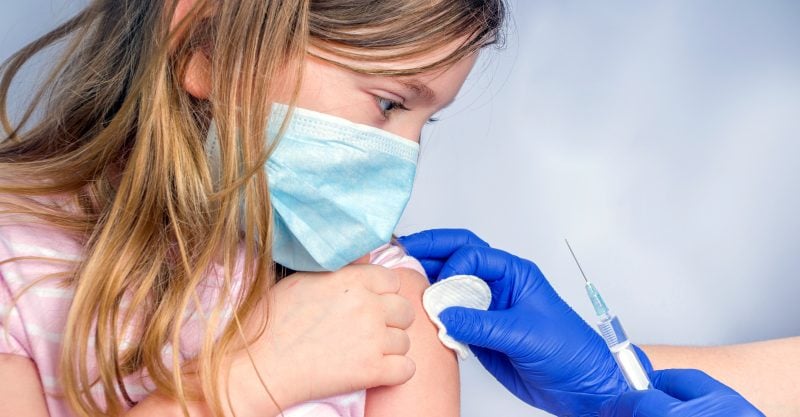
La Casa Blanca hoy desveló sus planes de poner en marcha las vacunas COVID para niños de 5 a 11 años, a pesar de que los expertos en seguridad de las vacunas – que asesoran a los reguladores de medicamentos de Estados Unidos y revisan los datos de seguridad y eficacia – no se han reunido para discutir si la vacuna COVID de Pfizer debe ser autorizada para su uso en el grupo de edad pediátrica.
El gobierno de Biden dijo que asegurará suficientes dosis de vacunas para vacunar a los 28 millones de niños de 5 a 11 años que serían elegibles si la vacuna se autoriza para ese grupo de edad, informó CNN.
La Casa Blanca también ayudará a equipar más de 25.000 consultorios pediátricos y de atención primaria, cientos de centros de salud comunitarios y clínicas de salud rurales, así como decenas de miles de farmacias para administrar la vacuna.
Jeff Zients, director de la respuesta a COVID-19 de la Casa Blanca, dijo que 15 millones de dosis estarán listas para ser enviadas en el plazo de una semana después de la autorización de la vacuna, y que a partir de entonces habrá millones de inyecciones adicionales cada semana.
“Sabemos que millones de padres han estado esperando la vacuna COVID-19 para los niños de este grupo de edad”, dijo Zients a los periodistas durante una reunión informativa sobre COVID. “Y en caso de que la FDA y (los Centros de Control y Prevención de Enfermedades de EE.UU.) autoricen la vacuna, estaremos preparados para ponernos las pilas”.
Zients dijo que los niños tienen necesidades diferentes a las de los adultos y “nuestra planificación operativa está orientada a satisfacer esas necesidades específicas, incluyendo la oferta de vacunas en entornos con los que los padres y los niños están familiarizados y en los que confían.”
La administración dijo que está lanzando una asociación con la Asociación de Hospitales de Niños “para trabajar con más de 100 sistemas de hospitales de niños en todo el país para establecer sitios de vacunación en noviembre y hasta el final del año calendario.”
La administración planea hacer que la vacunación esté disponible en la escuela y en otros “sitios basados en la comunidad” con la ayuda de la financiación de la Agencia Federal de Gestión de Emergencias.
El Departamento de Salud y Servicios Humanos de los Estados Unidos (“Health and Human Services”, HHS por sus siglas en inglés) también llevará a cabo una campaña nacional de educación pública “para llegar a los padres y tutores con información precisa y culturalmente sensible sobre la vacuna y los riesgos que COVID-19 supone para los niños”.
Al igual que en el caso de las vacunas para adultos, la administración cree que los mensajeros de confianza -educadores, médicos y líderes comunitarios- serán vitales para fomentar la vacunación, según “U.S. News & World Report”.
La Casa Blanca empezó a sentar las bases con los estados a principios de este mes, pidiendo a los gobernadores que inscribieran a los pediatras y otros proveedores en los programas de vacunación para que pudieran empezar a administrar las vacunas en cuanto estuvieran preparados.
“En la era de la variante Delta, los niños se infectan tan fácilmente como los adultos, y transmiten la infección tan fácilmente como los adultos”, dijo el miércoles a los periodistas el Dr. Anthony Fauci, principal asesor médico de la Casa Blanca. “Puede que no lo apreciemos, porque alrededor del 50% de las infecciones en niños son asintomáticas”.
Según la Academia Americana de Pediatría, menos del 2% de los niños infectados por el coronavirus son hospitalizados, y menos del 0,03% de los infectados mueren.
Como informó “The Defender” en junio, los expertos que testificaron ante la FDA, cuando ésta consideraba autorizar la vacuna de Pfizer para niños de 12 a 15 años, argumentaron que los riesgos no superaban los beneficios, incluso para ese grupo de edad.
Vacunar a los niños en beneficio de los adultos es un “beneficio hipotético no probado”, dijo a la FDA el doctor Peter Doshi, profesor asociado de la Facultad de Farmacia de la Universidad de Maryland y editor senior de “The BMJ”.
Doshi recordó a los funcionarios de la FDA que no pueden autorizar o aprobar un producto médico en una población a menos que los beneficios superen los riesgos en esa misma población.
“Si la FDA no tiene un listón alto para las EUA[Autorización de Uso de Emergencia] y las licencias, se pierde el sentido de la regulación”, dijo Doshi.
Los asesores en materia de vacunas de la FDA no tienen previsto reunirse hasta el 26 de octubre para estudiar la solicitud de Pfizer de autorizar su vacuna para niños de 5 a 11 años. En la reunión, los asesores revisarán los datos de la empresa y la propia evaluación de la FDA, y luego votarán si la FDA debe conceder la EUA.
Los CDC convocarán a su comité de expertos independientes en vacunas los días 2 y 3 de noviembre para establecer las recomendaciones oficiales sobre el uso de la vacuna.
Si se autoriza, sería la primera vacuna contra el COVID para los niños más pequeños. La vacuna de Pfizer-BioNTech está actualmente aprobada para personas mayores de 16 años y tiene autorización de emergencia para niños de 12 a 15 años.
Los CDC publican una guía sobre la administración de la vacuna de Pfizer-BioNTech a los niños antes de la reunión
La Casa Blanca no es la única que ha hecho oficiales los planes de vacunación de los niños de 5 a 11 años antes de que se autorice la vacuna para ese grupo de edad. Los CDC la semana pasada publicaron unas orientaciones en las que se describen los aspectos clave de un programa de vacunación contra la COVID para niños menores de 12 años “diseñadas para informar de la planificación jurisdiccional bajo el supuesto de la autorización de la FDA y las recomendaciones de los CDC de al menos un producto de vacunación contra la COVID-19 para niños de esta edad”.
La “Guía de planificación operativa de la vacunación pediátrica COVID-19” de los CDC incluye detalles sobre la vacuna prevista de Pfizer-BioNTech -aunque puede actualizarse a medida que otros fabricantes presenten solicitudes para su revisión por parte de la FDA- y se basa en “hechos actuales y supuestos de planificación”.
En el documento, los CDC exponen las diferencias entre la vacuna pediátrica y la de los adultos, dan una configuración detallada del producto y ofrecen una estrategia de distribución.
Además, los CDC informaron a los proveedores de la Ley de Preparación para Situaciones de Emergencia (“Public Readiness and Emergency Preparedness”, PREP por sus siglas en inglés) y La Declaración de la Ley PREP emitida por el Secretario del HHS “autoriza y proporciona protecciones de responsabilidad a los proveedores con licencia y a otros identificados en la declaración para administrar las vacunas COVID-19 autorizadas por la FDA, incluidas las vacunas COVID-19 autorizadas para su administración a niños”.
A partir del 20 de octubre, los estados y otras jurisdicciones podrán encargar por adelantado dosis de la vacuna COVID de Pfizer-BioNTech formulada para niños de 5 a 11 años, según el documento de planificación federal de los CDC. Los pedidos son en previsión de un despliegue que podría comenzar ya el 3 de noviembre.
Los CDC dijeron que las jurisdicciones deberían estar listas para vacunar a los niños de 5 a 11 años poco después, a la espera de la autorización de la FDA y la recomendación de los CDC.
“Al comprar ya la Casa Blanca 65 millones de dosis pediátricas de la vacuna de Pfizer-BioNTech, y al publicar los CDC unas directrices antes de la autorización de la FDA -por no hablar de una recomendación de su propio Comité Asesor sobre Prácticas de Inmunización-, estos actores están revelando que todo el proceso de regulación de las vacunas es una completa farsa”, dijo Mary Holland, presidenta de “Children’s Health Defense” en un correo electrónico enviado a “The Defender”.
“No podría haber mejor manera de socavar la confianza del público que dejar claro que esto es política, no ciencia”.