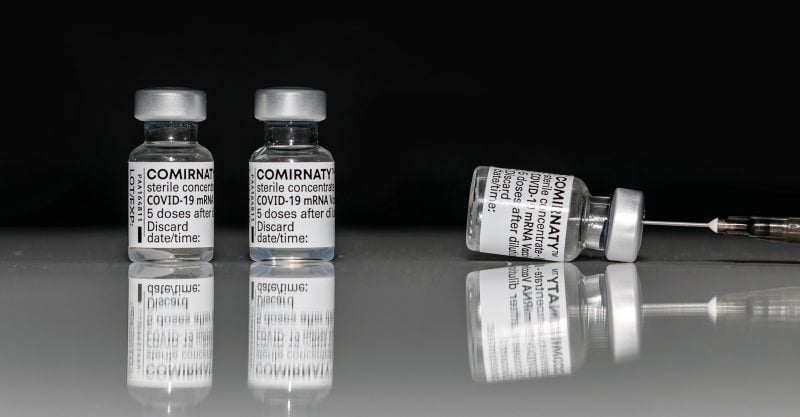
Dos medios de comunicación la semana pasada solicitaron, sin conseguirlo, a Pfizer que aclararasi su vacuna Comirnaty COVID con licencia completa está disponible en los Estados Unidos.
Los informes de “The Ohio Star” y “National File” destacaron el debate en curso sobre si la vacuna puede ser legalmente obligatoria, y si Pfizer puede ser considerado responsable de las lesiones relacionadas con la vacuna.
“The Star” informó de que, a pesar de preguntar en múltiples ocasiones si la vacuna Comirnaty está en uso, Pfizer no quiso responder a la pregunta.
La Administración de Alimentos y Medicamentos de los Estados Unidos (“Food and Drug Administration”, FDA por sus siglas en inglés) concedió en agosto la aprobación total, o aprobación de la solicitud de licencia biológica (“Biological License Application Approval”, BLA por sus siglas en inglés), para la vacuna Comirnaty para personas de 16 años o más.
La aprobación, concedida sin una reunión formal del comité consultivo ni comentarios del público, suscitó una serie de preguntas, entre ellas:
- Cuáles son las diferencias, si es que las hay, entre las formulaciones utilizadas en la vacuna Comirnaty plenamente autorizada y la vacuna de Pfizer-BioNTech que se está distribuyendo bajo la Autorización de Uso de Emergencia (“Emergency Use Authorization”, EUA por sus siglas en inglés).
- Si/cuando va a estar disponible la vacuna totalmente autorizada en los Estados Unidos.
En busca de una respuesta a esta última pregunta, “The Star” se puso en contacto con Pfizer, la FDA y el mayor sistema sanitario de Ohio, “OhioHealth”.
Una portavoz de “OhioHealth” confirmó que los 12 hospitales del sistema “están distribuyendo actualmente la vacuna de Pfizer que no tiene la etiqueta de la marca Comirnaty.”
En respuesta a si la vacuna Comirnaty se está utilizando en otros lugares de Estados Unidos, Pfizer dijo a “The Star” en un correo electrónico:
“La Vacuna COVID-19 de Pfizer-BioNTech (producto con etiqueta EUA) se está enviando actualmente; sin embargo, tenga en cuenta que la Vacuna COMIRNATY y la Vacuna COVID-19 de Pfizer-BioNTech tienen la misma formulación y pueden utilizarse indistintamente. Se fabrican con los mismos procesos y no hay diferencias entre ellas en cuanto a seguridad o eficacia.”
La afirmación de Pfizer de que las dos vacunas pueden “usarse indistintamente” es inconsistente con las declaraciones de la FDA, dijo “The Star”, citando una página de preguntas y respuestas de la FDA que afirma que las dos vacunas son “legalmente distintas”.
La FDA reafirmó esa distinción, diciendo a “The Star” que “las autoridades estatutarias que rigen los BLA y los EUA son distintas y establecen requisitos legales diferentes”.
La FDA “no abordó directamente” la pregunta inicial de “The Star” sobre la diferencia específica entre Comirnaty y la vacuna EUA, o por qué Pfizer no está enviando Comirnaty si las fórmulas son “intercambiables”.
Sin embargo, en una notificación del 9 de diciembre sobre la reemisión de la EUA para la vacuna original de Pfizer para administrar vacunas de refuerzo a jóvenes de 16 y 17 años, la FDA dijo:
“[a]unque COMIRNATY (Vacuna COVID-19, ARNm) está aprobada para prevenir la COVID-19 en individuos de 16 años o más, no hay suficiente vacuna aprobada disponible para su distribución a esta población en su totalidad en el momento de la reemisión de esta EUA”.
“The Star” también se puso en contacto con el fiscal general de Ohio, Dave Yost, para preguntarle si las universidades públicas de Ohio siguen la ley estatal, HB 244, que prohíbe a las instituciones públicas imponer una vacuna que no esté totalmente aprobada.
Bethany McCorkle, directora de comunicaciones de Yost, respondió que la HB 244 no se aplica porque “la FDA aprobó completamente las vacunas”.
“National File”, siguiendo la información de “The Star”, también se puso en contacto con Pfizer para preguntar si Comirnaty está en uso. Pfizer dijo a “National File” que “el producto con etiqueta EUA seguirá siendo enviado y utilizable hasta su fecha de caducidad.”
Pfizer no respondió a las solicitudes de seguimiento de “National File” para obtener aclaraciones adicionales.
Comirnaty ‘no disponible en este momento’
Según los Centros para el Control y la Prevención de Enfermedades (“Centers for Disease Control and Prevention”, CDC por sus siglas en inglés), una tabla que muestra la descripción de la terminología de procedimiento actual para la vacuna con licencia BLA de Comirnaty afirma que Comirnaty “no se puede encargar en este momento”.
La descripción actual de la terminología del procedimiento incluye una declaración de Pfizer:
“En la actualidad, Pfizer no tiene previsto fabricar ningún producto con estos nuevos NDC (National Drug Code) y etiquetas en los próximos meses mientras el producto autorizado por la EUA siga disponible y se ponga a disposición de la distribución en Estados Unidos. Por ello, es posible que los CDC, la AMA (Asociación Médica Americana) y los compendios de medicamentos no publiquen estos nuevos códigos hasta que Pfizer haya determinado cuándo se producirá el producto con las etiquetas de la BLA.”
Según una carta del 16 de diciembre de la jefa científica en funciones de la FDA, Jacqueline A. O’Shaughnessy, las vacunas de Pfizer-BioNTech exportadas desde Estados Unidos sólo se permiten si “las autoridades reguladoras del país en el que se utilizará la vacuna están plenamente informadas de que esta vacuna está sujeta a una EUA y no está aprobada ni autorizada por la FDA”.
La carta de O’Shaughnessy afirma que hay “una cantidad significativa de la Vacuna COVID-19 de Pfizer-BioNTech que fue fabricada y etiquetada de acuerdo con esta autorización de uso de emergencia. La autorización sigue vigente con respecto a la Vacuna Pfizer-BioNTech COVID-19 para esta población”.
En un intercambio en Twitter el pasado fin de semana, el representante Thomas Massie (republicano de Kentucky) citó la carta de O’Shaughessy para refutar un tuit de Joe Gerth, columnista del “Louisville Courier-Journal”, que afirmaba que Comirnaty está disponible.
Su primera frase, “Comirnaty está disponible en los Estados Unidos”, es falsa. Muéstrenos un lugar donde esté disponible para demostrar lo contrario.
La FDA exige a Pfizer que revele a otros países que BioNTech está “sujeto a una EUA y no está aprobado ni autorizado por la FDA”. https://t.co/kvCe6F01Wt https://t.co/rOORWwnvjn pic.twitter.com/kFQii84rBp
– Thomas Massie (@RepThomasMassie) 18 de diciembre de 2021
¿Pueden las vacunas ser “intercambiables” y “legalmente distintas” al mismo tiempo?
Las tergiversaciones de los medios de comunicación y los funcionarios públicos -como las del “Louisville Courier-Journal” y el fiscal general de Ohio, que afirman que las vacunas de Pfizer que se utilizan en Estados Unidos están aprobadas por la FDA-, junto con los propios documentos ambiguos de la FDA y las declaraciones públicas, han dado lugar a la confusión del público y a cuestiones legales.
La negativa de Pfizer a responder directamente a las preguntas planteadas por “The Ohio Star” y “National File” no hace sino aumentar la falta de claridad. Como dijo el comentarista político y abogado Robert Barnes a “The Star”:
“Se trata de un ilícito truco de ofrecer una cosa y dar otra. No hay ninguna vacuna COVID-19 aprobada por la FDA disponible en los EE.UU. El fármaco no disponible con licencia biológica de la FDA no es médicamente idéntico y tiene que cumplir con diferentes normas de fabricación. Lo que es más importante, usted tiene menos derechos legales y menos recursos legales cuando toma un medicamento EUA que un medicamento con licencia biológica. Esto afecta directamente a los derechos legales de todos los estadounidenses”.
La afirmación de la FDA de que las vacunas de Comirnaty y Pfizer son “jurídicamente distintas” pero “intercambiables” es el centro de los argumentos legales sobre si se pueden crear mandatos para una, ambas o ninguna de las dos vacunas.
Una demanda presentada por miembros del ejército contra el Departamento de Justicia de los Estados Unidos (“Department of Justice”, DOJ por sus siglas en inglés) que impugna el mandato de la vacuna COVID para todos los miembros del servicio pone de manifiesto algunos de los argumentos.
El 12 de noviembre, un juez federal denegó la solicitud de los demandantes de un requerimiento preliminar contra los mandatos del DOJ.
Sin embargo, en su sentencia, el juez declaró -en contra de las afirmaciones de Pfizer y la FDA- que la vacuna Comirnaty, autorizada por la FDA, no es intercambiable con la vacuna de Pfizer-BioNTech que lleva la etiqueta EUA.
El juez Allen Winsor, del Tribunal de Distrito de EE.UU. para el Distrito Norte de Florida, dijo que los miembros del servicio demostraron que el Departamento de Defensa de EE.UU. (DOD) les obliga a someterse a las vacunas con la etiqueta EUA, pero “el abogado de la defensa ni siquiera pudo decir si las vacunas con la etiqueta ‘Comirnaty’ existen en absoluto”.
El juez Winsor escribió:
“En opinión del Departamento de Defensa, esto está bien porque el contenido de los viales etiquetados como EUA es químicamente idéntico al contenido de los viales etiquetados como “Comirnaty” (si es que existen tales viales). Según el argumento del DOD, esto significa que los miembros del servicio no están obligados a aceptar “un producto autorizado para uso de emergencia”. …
“Más bien, el DOD argumenta que una vez que la FDA autorizó a Comirnaty, todos los viales etiquetados como EUA se convirtieron esencialmente en Comirnaty, aunque no estuvieran etiquetados así. Por lo tanto, el DOD argumenta que el “producto” inyectado es una formulación química que ha recibido la licencia completa de la FDA – no simplemente una EUA”.
El juez Winsor calificó ese argumento de “poco convincente”.
La distinción entre un producto con aprobación de uso de emergencia y uno con licencia completa plantea otras cuestiones jurídicas. Por ejemplo, la hoja informativa de la FDA sobre la vacuna Comirnaty dice:
“Esta EUA para la vacuna COVID-19 de Pfizer-BioNTech y COMIRNATY terminará cuando el Secretario del HHS determine que las circunstancias que justifican la EUA ya no existen o cuando haya un cambio en el estado de aprobación del producto de tal manera que ya no sea necesaria una EUA”.
La declaración parece sugerir que las vacunas de Pfizer-BioNTech y Comirnaty son EUA, y que ambas EUAs terminarán bajo las condiciones señaladas.
Otra diferencia clave entre las vacunas plenamente autorizadas y las de la EUA se refiere a la cuestión de la responsabilidad. En virtud de la Ley dePreparación y Preparación del Público (PREP Act)de 2005, las vacunas EUA van acompañadas de un escudo de responsabilidad de gran alcance que protege a todas las partes implicadas en el producto de las demandas judiciales.
En concreto, si uno sufre una lesión por una vacuna EUA, la única forma de reclamar daños y recibir una indemnización es solicitarlo al Programa de Compensación de Lesiones por Contramedidas, un proceso administrativo dependiente del Departamento de Salud y Servicios Humanos (“Health and Human Services”, HHS por sus siglas en inglés) de Estados Unidos, que autorizó las vacunas.
En este momento, la vacuna Comirnaty de Pfizer puede no tener un escudo de responsabilidad, por lo que está sujeta a las leyes de responsabilidad de productos que permiten a los que sean dañados por ella demandar potencialmente por daños y perjuicios, aunque Pfizer afirma que la vacuna está protegida también por la Ley PREP.
“Children’s Health Defense”, tras la aprobación de Comirnaty, demandó a la FDA argumentando que la aprobación era un truco de “ofrecer una cosa y dar otra” para dar protección a los mandatos de vacunación.