El 29 de octubre de 2021, la Administración de Alimentos y Medicamentos de Estados Unidos (FDA) concedió la autorización de uso de emergencia (“Emergency Use Authorization”, EUA por sus siglas en inglés) de la vacuna COVID-19 de Pfizer para niños de 5 a 11 años de edad.
Los Centros para el Control y la Prevención de Enfermedades (“Centers for Disease Control and Prevention”, CDC por sus siglas en ingés) pasaron a recomendar la vacuna COVID-19 de Pfizer para 28 millones de niños estadounidenses de 5 a 11 años de edad el 2 de noviembre de 2021.
Esta semana, Pfizer ha solicitado a la FDA que autorice el uso de una vacuna de dos dosis en niños de 6 meses a 4 años. Los datos sobre una tercera vacuna se presentarían a los reguladores una vez que estuvieran disponibles en la primavera, lo que despejaría el camino para que la agencia autorizara un régimen de tres vacunas para los niños más pequeños que pueden ser vacunados. La vacuna para este grupo de edad podría estar disponible ya en febrero.
Los sistemas de vigilancia de la seguridad de la FDA y de los CDC han encontrado un mayor riesgo de inflamación del corazón (miocarditis/pericarditis) tras la vacunación con la vacuna COVID-19 de Pfizer. Este riesgo observado fue mayor en los varones de 12 a 17 años, especialmente tras la segunda dosis.
Riesgos y beneficios de las vacunas
Para que se emita la autorización de uso de emergencia, EUA, para una vacuna, la FDA debe determinar que los beneficios de la vacuna superan los riesgos.
Según un comunicado de prensa de la FDA:
“La FDA llevó a cabo su propia evaluación de beneficios y riesgos utilizando un modelo para predecir cuántos casos sintomáticos de COVID-19, hospitalizaciones, ingresos en la unidad de cuidados intensivos (UCI) y muertes por COVID-19 evitaría la vacuna en niños de 5 a 11 años de edad frente al número de posibles casos de miocarditis, hospitalizaciones, ingresos en la UCI y muertes que podría causar la vacuna. El modelo de la FDA predice que, en general, los beneficios de la vacuna superarían sus riesgos en niños de 5 a 11 años de edad.”
Desgraciadamente, la evaluación de riesgos y beneficios de la FDA fue profundamente defectuosa y no tuvo en cuenta los siguientes factores de importancia crítica:
1. Inmunidad natural
Según los datos de los CDC, se estima que el 42% de los niños de entre 5 y 11 años tenían una seroprevalencia de infección previa por COVID-19 en junio de 2021. Estimaciones más recientes deberían sugerir tasas de seroprevalencia aún más altas entre los niños, dado que han pasado varios meses desde el momento en que apareció esta evidencia.
La evaluación de riesgos y beneficios de la FDA no tuvo en cuenta la gran proporción de niños en Estados Unidos que ya habían tenido COVID-19, se habían recuperado de ella y ahora tienen inmunidad natural.
Para estos millones de niños, los riesgos de la vacunación contra el COVID-19 superan los beneficios, ya que los estudios demuestran que la inmunidad natural es superior a la inducida por la vacuna.
Un asesor principal de la FDA para la evaluación de riesgos y beneficios admitió que si la inmunidad natural fuera igual a la inducida por las vacunas, eso supondría una reducción del 45% de todos los beneficios en los análisis de riesgos y beneficios de la FDA.
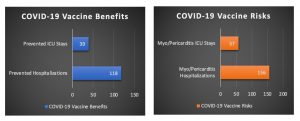
Varones de 5 a 11 años (casos por millón)

Utilizando el análisis de riesgo-beneficio de la FDA (mostrado arriba) y ajustando de forma conservadora el 42% de los niños que ya han adquirido la inmunidad natural a través de una infección previa por COVID-19, el riesgo de hospitalización por inflamación del corazón relacionada con la vacuna en niños de 5 a 11 años es mayor que el número de hospitalizaciones por COVID-19 que se evitan con la vacunación.
Como se ilustra a continuación, al ajustar la inmunidad natural (con una reducción del 42% de los beneficios de la vacuna), se evitan 39 estancias en la UCI mediante la vacunación, pero con el riesgo de 57 estancias en la UCI por miopericarditis relacionadas con la vacuna.
Además, si bien se evitan 118 hospitalizaciones con la vacunación, se corre el riesgo de que se produzcan 156 hospitalizaciones por miopericarditis relacionadas con la vacuna, en el caso de los niños de 5 a 11 años.
Varones de 5 a 11 años (casos por millón)
2. Tasas de miocarditis subestimadas
El análisis de riesgo-beneficio de la FDA asumió una tasa de incidencia de 106 casos de miopericarditis por cada millón de niños vacunados. Sin embargo, un estudio de Kaiser Permanente descubrió que la tasa de incidencia real de la miopericarditis es de 208 casos por cada millón de niños vacunados.
Los autores del estudio escriben lo siguiente:
“La verdadera incidencia de la miopericarditis es notablemente más alta que la incidencia comunicada a los comités consultivos estadounidenses… identificamos que la metodología de descripción del texto del encuentro identificó aproximadamente el doble de casos de miopericarditis tras la vacunación con ARNm COVID-19”.
Hombres y mujeres de 5 a 11 años (casos por millón)
-

Escenario de modelización “base” de la FDA: análisis de riesgos y beneficios (niñosy niñas combinados)
Utilizando el análisis riesgo-beneficio de la FDA (mostrado arriba) y corrigiendo la tasa subestimada de miopericarditis tras la vacunación (utilizando un factor de multiplicación de 1,96), llegamos a 67 estancias en la UCI y 180 hospitalizaciones por miopericarditis por cada millón de niños vacunados.
Al ajustar también la inmunidad natural (con una reducción del 42% de los beneficios de la vacuna), calculamos que se evitan 36 estancias en la UCI y 111 hospitalizaciones gracias a la vacunación. Después de corregir la tasa de miopericarditis subestimada por la FDA y de ajustar la inmunidad natural, encontramos que el riesgo de hospitalización por miopericarditis relacionada con la vacuna es mayor que el número de hospitalizaciones por COVID-19 evitadas por la vacunación, para niños y niñas (como se ilustra a continuación).
Niños y niñas de 5 a 11 años (casos por millón)
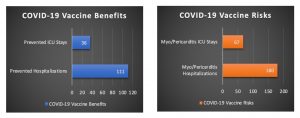
[Cálculos: 62 estancias evitadas en la UCI x (1 – 0,42) ajuste de inmunidad natural = 36 estancias evitadas en la UCI después del ajuste. 192 hospitalizaciones evitadas x (1 – 0,42) ajuste de inmunidad natural = 111 hospitalizaciones evitadas tras el ajuste. Factor de multiplicación de 1,96 = 208 (incidencia real de miopericarditis por millón de niños vacunados) / 106 (incidencia subestimada por la FDA de miopericarditis por millón de niños vacunados). 34 estancias excesivas en la UCI por miopericarditis x 1,96 (factor de multiplicación) = 67 estancias en la UCI por miopericarditis relacionadas con la vacuna después del ajuste. 92 exceso de hospitalizaciones por miopericarditis x 1,96 (factor de multiplicación) = 180 hospitalizaciones por miopericarditis relacionadas con la vacuna tras el ajuste].
3. Sobreclasificación de las hospitalizaciones COVID-19
Las tasas de hospitalización pediátrica, aunque se utilizan como marcador de la gravedad de la enfermedad COVID-19 en los niños, pueden estar infladas por la detección de una infección leve o asintomática a través del cribado universal.
Un estudio de la Universidad de Stanford descubrió que es poco probable que el 45% de los ingresos hospitalarios por COVID-19 pediátrico hayan sido causados por el SARS-CoV-2.
Fauci: “Si miras a los niños que están hospitalizados, muchos de ellos lo están con Covid, en lugar de a causa de Covid”. pic.twitter.com/57Rdx8gPg3
– The Post Millennial (@TPostMillennial) 31 de diciembre de 2021
Según un funcionario médico de los CDC, en los datos de COVID-NET aproximadamente el 19% de los niños más pequeños que fueron clasificados como ingresos hospitalarios por COVID-19 no fueron hospitalizados principalmente debido a COVID-19.
Inexplicablemente, la FDA no tuvo esto en cuenta en su evaluación de riesgos y beneficios.
4. Tasas de hospitalización COVID-19 infladas
Según los datos de COVID-NET, a partir del 25 de diciembre de 2021, la tasa semanal de hospitalización asociada a COVID-19 osciló entre cero y un pico de 1,1 por cada 100.000 niños de 5 a 11 años.
En el momento de la evaluación de riesgos y beneficios de la FDA, la tasa media semanal de hospitalización asociada a COVID-19 en este grupo de edad era de aproximadamente 0,4 por cada 100.000 niños.
En lugar de utilizar el promedio semanal de la tasa de hospitalización por COVID-19 desde el inicio de la pandemia, la evaluación de riesgos y beneficios de la FDA utilizó un promedio arbitrario de las cuatro semanas anteriores al 11 de septiembre de 2021, lo que dio como resultado una tasa de hospitalización por COVID-19 de aproximadamente 0,74 por cada 100.000 niños (que es casi el doble de la tasa promedio de hospitalización por COVID-19 de 0,4 por cada 100.000 niños).
Esto sesgó aún más el análisis riesgo-beneficio de la FDA a favor de la vacunación.
5. Disminución de la inmunidad
La evaluación de riesgos y beneficios de la FDA asumió una eficacia constante de la vacuna durante un periodo de seis meses. Esta era una suposición inadecuada, ya que está bien establecido que la eficacia de la vacuna COVID-19 de Pfizer disminuye rápidamente con el tiempo, con un estudio que muestra una caída por debajo del 50% de eficacia después de cinco meses.
Además, la evaluación de riesgos y beneficios de la FDA no tuvo en cuenta potencialmente se iba a necesitar una dosis de refuerzo después de cinco meses. Cada dosis de refuerzo conllevaría un riesgo adicional de miocarditis, junto con el riesgo de otros efectos adversos de la vacuna.
6. Reacciones adversas a las vacunas
La FDA sólo tuvo en cuenta los riesgos de miocarditis/pericarditis tras la vacunación, pero no tuvo en cuenta las reacciones adversas y otros acontecimientos adversos en su evaluación de riesgos y beneficios.
Durante un periodo de seis meses, el análisis de riesgo-beneficio de la FDA estimó que se podrían prevenir 45.773 casos de COVID-19 vacunando completamente a un millón de niños de entre 5 y 11 años.
Sin embargo, este beneficio de la vacunación tendría el riesgo de un enorme número de reacciones adversas a la vacuna (véase la sección 7.6.2 Reacciones adversas solicitadas): aproximadamente 258.000 casos de dolor moderado a intenso en el lugar de la inyección; 174.000 casos de fatiga; 94.000 dolores de cabeza; 65.000 casos de fiebre; 55.000 casos de escalofríos; 24.000 casos de diarrea; 18.000 casos de vómitos; y 82.000 casos de dolor muscular o articular.
Estas reacciones adversas se sumarían a otros eventos adversos, como: anafilaxia; linfadenopatía; síncope; y parálisis de Bell.
Además, los datos procedentes del Reino Unido han demostrado que las personas con una infección previa por COVID-19 tienen más probabilidades de experimentar efectos secundarios sistémicos tras la vacunación con COVID-19.
El coste de oportunidad (la consecuencia de elegir una opción u otra)
El análisis de riesgo-beneficio de la FDA estimó que la vacunación completa de 1 millón de niños de 5 a 11 años evitaría un caso de muerte por COVID-19.
A un precio pandémico de 19,50 dólares por dosis de la vacuna de Pfizer, costaría 39 millones de dólares evitar una sola muerte por COVID-19 en un niño de este grupo de edad.
Esto nos lleva a preguntarnos: ¿Cuántas vidas más podrían salvarse si esta misma suma de dinero se gastara en otro lugar?
Conclusión:
La FDA se basó en una evaluación de riesgo-beneficio críticamente defectuosa para justificar la autorización de uso de emergencia de la vacuna COVID-19 de Pfizer para niños de 5 a 11 años de edad.
En el contexto de la variante Omicron, que se asocia a una enfermedad menos grave y a menores tasas de hospitalización, la relación beneficio-riesgo de la vacunación con COVID-19 para los niños de 5 a 11 años de edad resulta aún más difícil de justificar.
Teniendo en cuenta todo lo anterior, es fácil entender por qué Suecia decidió no recomendar las vacunas COVID-19 para los niños de 5 a 11 años. Argumentando que los beneficios no superan los riesgos, un funcionario de la Agencia Sueca de Salud declaró:
“Con los conocimientos que tenemos hoy, con un bajo riesgo de enfermedad grave para los niños, no vemos ningún beneficio claro con la vacunación”.







